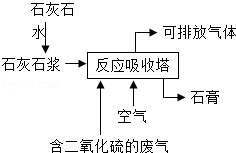
工业用石灰石浆吸收废气中的二氧化硫,并制取石膏(主要成分为硫酸钙).简易流程如图,主要的反应为:2CaCO 3+2SO 2+O 2═2CaSO 4+2X
(1)流程中石灰石加水制成石灰石浆的目的是 .反应中X的化学式为 ,硫元素的化合价在反应前后的变化为 .
(2)减少二氧化硫的排放,主要为了 (填序号)
A、减缓温室效应 B、减少酸雨形成 C、防止破坏臭氧层
(3)按上述方法处理2000吨废气中的SO 2,至少需要含5吨碳酸钙的石灰石浆.求:废气中SO 2的质量分数.
绍兴市获得2015年度全省“五水共治”工作优秀市并被授予大禹鼎,“五水共治”是指治污水、防洪水、排涝水、保供水、抓节水,还社会一个蓝天碧水,为百姓创造美好的生活环境。
某化工厂流程会产生澄清废水,其中可能含有的离子是Ag+、Cu2+、Cl﹣、NO3﹣,已知:白色的沉淀Fe(OH)2在空气中会迅速转化为红褐色的Fe(OH)3。
(1)取少量废水,加入过量稀盐酸,产生白色沉淀;再加入过量氢氧化钠溶液,产生蓝色沉淀。该废水中含有的金属离子是 。
(2)兴趣小组设计了一个除去该废水中原有金属离子的实验方案,部分流程如图所示。操作I的名称是 ,单质A是 。

某兴趣小组为了研究露置于空气中的纯净生石灰(CaO)变质情况,进行了如下实验:
①称取生石灰25克,将其露置于空气中。
②一段时间后,称量发现质量增加了4克。
③将变质的“生石灰”溶于足量的稀盐酸,产生的气体全部通过足量的浓硫酸后,再通入足量的氢氧化钠溶液中,充分反应后称得氢氧化钠溶液的质量增加2.2克。
回答下列问题。
(1)变质的“生石灰”与稀盐酸反应生成二氧化碳的质量为 克。
(2)组成变质的“生石灰”各成分质量为多少?
(3)生石灰露置于空气中质量增加的原因是 ,故实验室中的生石灰应 保存。
我国科学家屠呦呦因为“发现青蒿素(化学式为C15H22O5)﹣一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”而获得2015年诺贝尔生理学或医学奖.磺胺(化学式为C6H8N2O2S)是青蒿素之前最热门的抗疟药物之一.
回答下列问题.
(1)一个青蒿素分子中含有 个原子.
(2)青蒿素中的氢元素与氧元素的质量比是 .
(3)14.1克青蒿素中含有碳元素的质量和多少克磺胺中含有碳元素的质量相等?
某工厂废液中含有CuSO 4(其他成分不含铜元素),现按以下流程回收金属铜.

(1)回收过程中,加入适量稀硫酸可除去过量铁屑,该反应的化学方程是为Fe+H 2SO 4═FeSO 4+H 2↑,这个反应所属的基本反应类型是 .
(2)洗涤后的滤渣不能用加热的方法干燥,其原因是 .
(3)现有一批废液,其中含4吨CuSO 4,理论上可从该废液中回收得到多少吨金属铜?
为适应不同人群的需要,市场上供应的食盐除普通碘盐外还有无碘竹盐、低钠盐和健康平衡盐等,现有两种品牌的食盐A和B,主要成分的含量见表:(注:两种食盐仅NaCl中含有钠元素:35.1g/100g表示每100g食盐中含钠元素质量为35.1g)
|
食盐种类 |
食盐A |
食盐B |
|
主要成分的含量 |
(以钠元素质量计)35.1g/100g |
(以NaCl质量计)93.0g/100g |
(1)加碘盐是通过加入KIO 3的方法制成的,KIO 3中碘元素的化合价为 。
(2)NaCl中钠元素质量分数以39%计,请比较食盐A、B中NaCl含量高低,其中含量较高的是 (填食盐种类)。