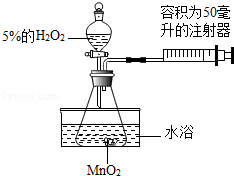
小金为了探究温度对H2O2分解反应速率的影响,借助如图所示实验装置(夹持装置略去),进行了两次实验,两次实验的部分设计如表所示:
实验1 |
实验2 |
|
MnO2的质量/克 |
0.5 |
0.5 |
5%的H2O2的体积/毫升 |
40 |
待填 |
水浴温度/℃ |
20 |
80 |
(1)实验2中应加入5%H2O2 毫升;
(2)在两次实验中,可通过 来比较H2O2分解反应速率的大小;
(3)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有 ;
(4)实验结束后若要将MnO2从混合物汇总分离出来,可采取的方法是 。
某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,同学们进行了以下探究:
[提出问题]
氢氧化钠溶液是否变质?变质程度如何?
[做出猜想]
猜想一:氢氧化钠溶液未变质
猜想二:氢氧化钠溶液完全变质
猜想三:
[设计实验]请完成实验报告
|
实验步骤 |
实验现象 |
实验结论 |
|
①取少量溶液于试管中,加入 ,充分反应。 |
|
猜想二成立 |
|
②将步骤①试管中的物质过滤,向滤液中加入 。 |
无明显现象 |
[反思拓展]
(1)氢氧化钠溶液变质的原因 (用化学方程式表示),氢氧化钠溶液应 保存。
(2)分别取两份完全变质的氢氧化钠溶液样品于试管中,向其中一份加入盐酸有气泡产生,另一份加入氢氧化钙溶液有白色沉淀产生,然后将两支试管中所有物质一起倒入废液缸中,得到无色澄清溶液,所得溶液中溶质一定有 。

如图是初中化学实验室制取气体的常用装置图,请回答下列问题:
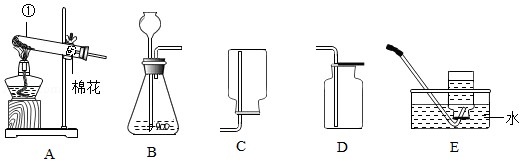
(1)仪器①的名称是 ;
(2)实验室制取二氧化碳选择的发生和收集装置是 (填写装置下方的字母);
(3)若用高锰酸钾制取氧气应选用的发生装置是 (填写装置下方的字母),写出该反应的化学方程式 ,检验氧气的方法是 ,排水法收集氧气不纯的原因是 (答一点即可)。
化学是以实验为基础的科学,实验是科学探究的重要手段。根据图示回答下列问题:
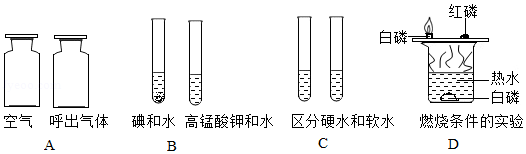
(1)A实验中,将 分别插入两个集气瓶中,比较氧气含量多少;
(2)B实验中,向两支试管中分别加入1﹣2小粒的碘和高锰酸钾,再各加入5mL水振荡,现象如图所示,由此得出的实验结论 ;
(3)C实验中,若要区分硬水和软水,向两支试管中分别加入等量的 ,生活中通过 可以降低水的硬度;
(4)D实验中,铜片上白磷燃烧,水中白磷不燃烧,由此得出燃烧的条件之一是 。
具备基本的化学实验技能是完成化学实验的基础和保证。请回答下列问题:
(1)固体药品通常盛放在 里;吸取和滴加少量液体的仪器名称是 ;
(2)用酒精灯加热试管里的液体时,液体不应超过试管容积的 ;
(3)用量筒量取8毫升水时,若仰视读数,则实际量取液体的体积 8毫升(选填"大于"、"小于"或"等于");
(4)蒸发操作时,用玻璃棒搅拌的目的是 。
"绿水青山就是金山银山",保护环境势在必行。请回答下列问题:
(1)请写出造成水体污染的原因 (答一点即可)。
(2)请写出酸雨的危害 (答一点即可)。
(3)在汽油中加入适量乙醇作为汽车燃料(车用乙醇汽油),请写出使用乙醇汽油的一条优点 。