侯德榜是我国著名的化学家,发明了侯氏制碱法,为纯碱和氮肥工业技术的发展作出了杰出的贡献。工业上以半水煤气(主要成分是N2、H2、CO、CO2和H2O)、食盐等为原料制取纯碱的流程如下:
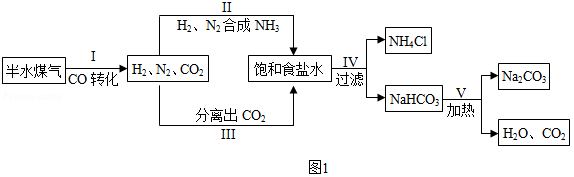
(1)流程中循环利用的物质有H2O和 。
(2)步骤Ⅰ中,在使用铜催化剂和加热条件下,半水煤气主要成分间发生反应实现了CO转化,化学方程式是 。
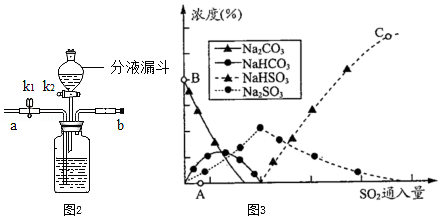
(3)实验室从混合气体H2、N2、CO2中分离出CO2的实验装置如图所示。广口瓶和分液漏斗中盛放的药品分别是 、 。
(4)除去纯碱中少量碳酸氢钠杂质的方法是 。
(5)纯碱用途广泛。工业上可用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3,达到减少污染、节约资源的目的。反应过程中溶液组成变化如图3所示。
①吸收初期(图中A点以前)反应的化学方程式为 。
②不断通入SO2,最终产物是 。
请根据下列实验装置图,回答有关问题:
(1)若选择,A、D装置,连接导管口a、d可以制取某种气体,该反应的化学方程式为 。
(2)相对于B装置来说,C装置的优点是 。
(3)简述用D装置收集氧气时的验满方法: 。
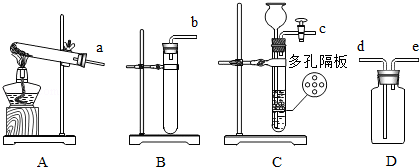
根据下列实验装置或操作示意图回答问题:

(1)用图A装置干燥O2,广口瓶内盛放的试剂是 ,气体应从 (填“a”或“b”)口进入.
(2)图B是蒸发食盐水操作,缺少的仪器是 ,组装该装置时,放置仪器的先后顺序是 (填数字序号).
①铁架台 ②铁圈 ③蒸发皿 ④酒精灯
(3)配制一定溶质质量分数的氯化钠溶液,图C中称量操作的错误之处是 .若其他操作均正确,按图D所示量取蒸馏水,则配制的氯化钠溶液浓度会 (填“偏大”“偏小”或“无影响”).
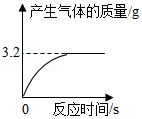
化学兴趣小组用一瓶久置的过氧化氢溶液制取氧气并测量过氧化氢质量分数。称量68g过氧化氢溶液和0.1g二氧化锰进行实验,反应前后质量随时间变化关系如图。计算:
(1)制得氧气的质量是 g。
(2)过氧化氢质量分数是多少?

实验室有一瓶失去标签的过氧化氢溶液,为测定其溶质质量分数,兴趣小组同学取l00g该溶液与1g二氧化锰混合,使其充分反应,产生气体的质量和反应时间关系如图。
(1)完全反应后,经过滤、烘干,得到固体的质量为 (不计操作过程中的损耗)
(2)产生气体的速度越来越慢的原因是 。
A.二氧化锰越来越少
B.过氧化氢溶液的溶质分数越来越小
C.温度越来越高
(3)计算所用过氧化氢溶液的溶质质量分数。(规范写出计算过程)
工业合成盐酸中通常溶有少量的FeCl 3.工业合成盐酸的国家质量标准规定:含HCl的质量分数<31.0%或含铁(以Fe计) 的质量分数>0.01%的产品均为不合格产品.某厂质检室对本厂生产的某一批次工业合成盐酸进行质量检验,方法是:取该批次产品l00g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示.请你计算产品中含HCl的质量分数和含铁(以Fe计) 的质量分数,并判断该批次产品是否合格.(写出计算过程,计算结果精确到0.1%)
