海洋是巨大的资源宝库,从海洋中可以获得很多物质,连云港水资源丰富。
(1)通过晾晒海水得到的粗盐中含有多种可溶性杂质和不溶性杂质(泥沙等)。实验室中除去粗盐中不溶性杂质获得精盐的步骤是:溶解→过滤→蒸发→计算产率等。
①过滤操作中玻璃棒的末端要轻轻的斜靠在 一边。蒸发时为防止液滴飞溅,除用玻璃棒搅拌外,还可以采取的操作是 。
②下列操作可能导致精盐产率偏高的是 (填字母)
a.食盐没有完全溶解即过滤 b.过滤时液面高于滤纸边缘
c.器皿上粘有的精盐没有全部转移到称量纸上
(2)海水中含量最多的氯化物是氯化钠,其次是氯化镁。如图1是从海水中获得氯化镁溶液的流程。

①在海水中加入石灰乳后,发生反应的化学方程式是 。
②上述过程中试剂A与沉淀B发生的是中和反应,则试剂A是(填名称) 。
(3)2017年5月18日,在中国南海海域实现可燃冰(CH 4•nH 2O)试采成功,这将使人类能源格局翻开新篇章。
①可燃冰中,水分子形成一种空间笼状结构,甲烷和少量N 2、CO 2等分子填入笼内空隙中,无固定的化学计量关系,因此可燃冰属于 (选填"纯净物"或"混合物")。
②若某种可燃冰中CH 4与H 2O的质量比是1:9,则该可燃冰中n= 。
③可燃冰中甲烷完全燃烧的化学方程式是 。
(1)在自来水厂取水口管道入口处设有拦污栅,此处相当于实验基本操作中的 .水厂工人在清理拦污栅的垃圾时经常发现有:①菜叶②纸皮③香蕉皮④易拉罐⑤塑料饮料瓶,其中可回收的有 (填序号).
(2)地球上总水量虽然很大,但淡水资源很少,我们必须爱护水资源,一方面要 ,另一方面要 (从"节水、防治水体污染"两个角度回答的合理答案均得分).
(3)在常温下完全电解90mL的水,正极与负极产生的气体的体积比为 ,产生氧气的质量为 克(设常温下水的密度为1g/cm 3).
Na2CO3和NaHCO3有很多相似的化学性质,例如它们都能与稀盐酸反应生成 气体。某学习小组对它们的鉴别方法产生了探究兴趣。
【提出问题】如何鉴别Na2CO3和NaHCO3呢?
【查阅资料】(1)NaHCO3固体受热分解生成碳酸钠和两种氧化物。
(2)Ca(HCO3)2可溶于水。
(3)通常状况下,NaHCO3是一种白色晶体,溶解度小于Na2CO3的溶解度,饱和的Na2CO3溶液中通入CO2气体,可生成NaHCO3。
【作出猜想】猜想一:可用酚酞溶液鉴别Na2CO3和NaHCO3溶液。
猜想二:可用加热的方法鉴别Na2CO3和NaHCO3固体。
猜想三:可用澄清石灰水鉴别Na2CO3和NaHCO3溶液。
猜想四:可用CO2气体鉴别Na2CO3和NaHCO3溶液。
小组同学一致认为猜想一不正确,理由是 。
【实验探究】请你与小组同学一起探究。
|
实验操作 |
实验现象 |
实验结论 |
|
|
实验1 |
分别取少量的Na2CO3和NaHCO3 固体于试管中加热,并将产生的气体通入澄清石灰水 |
加热Na2CO3时,澄清石灰水无变化;加热NaHCO3时,澄清石灰水变浑浊 |
|
|
实验2 |
分别取少量Na2CO3和NaHCO3溶液于试管中,加入澄清石灰水 |
两支试管中均产生了白色沉淀 |
猜想三 不正确 |
|
实验3 |
往盛有饱和Na2CO3和NaHCO3溶液的两支试管中分别通入足量的CO2气体 |
观察到 |
猜想四 正确 |
【问题讨论】
同学们对实验2的实验现象进行分析。从物质在溶液中解离出不同离子的微观角度分析,Na2CO3溶液与澄清石灰水发生反应的本质原因是 ,该反应的基本类型是 。石灰水与NaHCO3溶液也能反应生成白色沉淀,老师指出其反应原理较复杂,有待于今后学习中进一步探究。
【拓展应用】
除去固体Na2CO3中混有的少量NaHCO3,可用的方法是 (用化学方程式表示)。
某学习小组用图中的仪器或装置制备气体,请回答有关问题:

(1)请写出图中标有序号仪器的名称:① ; ② 。
(2)实验室用高锰酸钾制取氧气的化学方程式为 ,其发生装置可选择 (填序号)进行组装。组装仪器时,将玻璃管插入胶皮管前,先把玻璃管口 ,然后稍稍用力即可把玻璃管插入胶皮管内。
(3)若用E装置收集二氧化碳,验满方法是 。
(4)实验室若用块状固体和液体无需加热制取气体,发生装置可用D或F(有孔塑料板用来放块状固体)。和D相比,F装置的优点是 。
有一包固体X,可能由NH4NO3、FeCl3、NaOH、Na2SO4、CaCO3、Ba(NO3)2中的两种或两种以上物质组成。为探究其成分,进行如下实验:
(1)取少量固体X与熟石灰研磨,无氨味。则原固体中一定不含 。
(2)另取少量固体X按图中的甲进行实验。
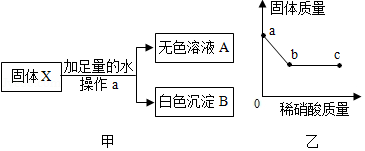
①操作a的名称是 ,由甲实验判断,原固体中一定不含 。
②取白色沉淀B于烧杯中并逐滴加入稀硝酸,烧杯中固体质量随滴入稀硝酸质量的变化如图乙所示。则白色沉淀B的成分为 ,图乙中c点时烧杯中的溶液一定含有的阳离子是 。
(3)为进一步探究原固体X的组成,取无色溶液A,向其中通入CO2气体,产生白色沉淀,由此判断固体X中还含有 。
2015年10月,我国科学家屠呦呦获得诺贝尔生理学或医学奖,她发现用于治疗疟疾的药物﹣﹣青蒿素(C 15H 22O 5)。青蒿素是一种无色针状晶体,味苦,几乎不溶于水,可溶于乙醇、乙醚,它对热不稳定,容易受湿、热和还原性物质的影响而分解。请结合短文的信息及所学的化学知识,回答下列问题:
(1)从含不含碳元素的角度分析,青蒿素和乙醇都属于 。
(2)请写出青蒿素的一种物理性质 。青蒿素药品应该 保存。
(3)乙醇俗称 ,是一种常用溶剂,还可用作酒精灯、内燃机的燃料,请写出其燃烧的化学方程式 。