溶液在生产、生活中起着十分重要的作用。请回答下列问题:
(1)可以作为溶质的是 。
A.只有固体 B.只有液体 C.只有气体 D.气体、液体、固体都可以
(2)配制100g质量分数为16%的氯化钠溶液,所需氯化钠的质量为 ,水的体积为 mL (水的密度近似看作1g/cm 3)。
(3)甲、乙两种不含结晶水的固体物质的溶解度曲线如图1.t 1℃时,甲物质的溶解度是 。t 2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是 (填"甲"或"乙")物质的饱和溶液。
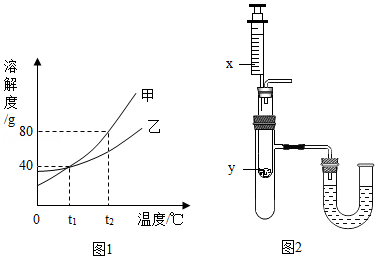
(4)按图2所示装置,将液体X注入装有固体y的试管中,会导致U形管中右端液面升高。则可能的组合是 。
选项 |
x |
y |
A |
水 |
氧化钙 |
B |
水 |
硝酸铵 |
C |
浓硫酸 |
水 |
D |
稀盐酸 |
镁 |
通过初中化学的学习,同学们掌握了一些基本的化学知识,初步形成了一些化学观念,具备了一定的化学科学素养.
(1)请完成下列表格:
|
化学符号 |
|
5CH4 |
|
2Cl﹣ |
|
表示意义 |
2个铝原子 |
|
氧化铁 |
|
(2)用所学知识,按要求完成下列各题:
a.周末,小星妈妈做晚饭炒菜时突然来一电话,在接电话时,听到正在忙于中考复习的小星大喊:“妈妈,锅里糊了!”接完电话,妈妈问道:“你又没看到,是怎么知道的?”小星解释道: .
b.“镁条在氧气中燃烧后固体质量增重,则质量守恒定律不适用于该化学反应”.你对这句话如何理解: .
c.前不久,某化妆品的广告片中有一女星高喊:“我们恨化学”,此广告语引起我国化学界高度关注,要求立即停播并公开道歉.你如何评价该广告语: .
A﹣H是初中化学常见物质,如图为这些物质的相互转化关系图,其中E为红色固体,H为红褐色沉淀,其中部分生成物与反应条件已省略.回答下列问题:

(1)F的化学式为 .
(2)E→C化学方程式为 .
(3)上述反应中未涉及的基本反应类型为 .
(4)萃出E→G在工业生产中对应的一种用途 .
请从C、H、N、O、K五种元素中选择恰当元素按要求用化学式或离子符号填空:
(1)被称为“绿色能源”,也是化学实验室中常用的燃料
(2)溶于水能导致溶液温度明显降低
(3)能作为复合肥的是
(4)具有10个电子的原子团 (填一种即可)
将15g混有少量氯化钠的碳酸钠粉末加入80g的水中,完全溶解,再向其中加入76g氯化钙溶液,两者恰好完全反应,将产生的沉淀过滤,得到161g滤液.计算:
(1)产生沉淀的质量
(2)原粉末中碳酸钠的质量
(3)反应后所得溶液中溶质的质量分数.
氢氧化钠是常见的碱,为探究氢氧化钠的化学性质,同学们做了如下实验:

【资料】氯化镁溶液不能使酚酞溶液变红。
(1)A中溶液呈红色,说明氢氧化钠溶液显碱性,要测定它的酸碱度,可使用 。
(2)B中没有明显的现象,该反应真的发生了吗?有同学提出,可向反应后的溶液中加入某些物质,根据相应的现象来判断,下列分析正确的有 (填数字序号)
①加入Na2CO3溶液,如果不产生气泡,能证明反应发生
②加入CuSO4溶液,如果不产生蓝色沉淀,能证明反应发生。
③加入紫色石蕊溶液,如果溶液呈紫色,能证明反应发生。
(3)C中发生反应的化学方程式是 。该实验证明碱能与某些盐反应。
(4)实验结束后,将三支试管中的物质倒入一只洁净的烧杯中,烧杯中出现白色沉淀,静置,上层清液无色。
【提出问题】上层清液中溶质的成分是什么呢?(指示剂除外)
【作出猜想】经过讨论,大家作出两种合理的猜想:
①NaCl;②
【实验验证】将猜想②补充完整并设计实验加以验证。
|
实验操作 |
实验现象 |
结论 |
|
取少量上层清液于试管中,滴加 溶液 |
|
猜想②正确 |
老师提醒同学们,实验结束后氢氧化钠溶液仍要密封保存,原因是 (用化学方程式表示)