实验探究和证据推理是提升认知的重要手段。化学兴趣小组对"CO还原Fe 2O 3粉末"的实验进行探究:
Ⅰ探究CO与Fe 2O 3的反应产物(夹持仪器已略去)
【实验过程】步骤1 在通风橱中,按图Ⅰ连接装置并检验装置的气密性。
步骤2 装入试剂:玻璃管内装入Fe 2O 3粉末,试管Ⅰ中装入澄清石灰水。
步骤3 从a端通入CO一段时间,待 ,再点燃酒精灯。
【实验现象】反应一段时间后,玻璃管内粉末由 色变成黑色,生成的黑色固体均能被玻璃管上方的磁铁吸引。试管Ⅰ中出现白色沉淀(用化学反应方程式表示: )。
【查阅资料】铁粉、FeO、Fe 3O 4均为黑色固体;铁粉、Fe 3O 4均能被磁铁吸引。
【提出猜想】对磁铁吸引的黑色固体成分有以下三种猜想:
猜测Ⅰ:Fe; 猜测Ⅱ:Fe 3O 4; 猜测Ⅲ:Fe和Fe 3O 4
【实验验证】取少量反应后的黑色固体放入试管中,加入足量的硫酸铜溶液,振荡,充分反应后静置,观察到红色固体中混有黑色颗粒,说明 (填"猜想Ⅰ""猜想Ⅱ"或"猜想Ⅲ")是正确的。
【拓展研究】进一步查阅资料,发现CO能溶于铜液[醋酸二氨合铜(Ⅰ)和氨水的混合液].因此可在装置Ⅰ后再连接下图装置Ⅱ,其目的是 ,装置Ⅰ、Ⅱ的连接顺序:b连接 (填"c"或"d")。

Ⅱ原料气CO的制备
方法一:加热MgCO 3、Zn的混合物可快速制备CO,同时还得到两种金属氧化物: 、 (填化学式)。
方法二:加热草酸晶体(H 2C 2O 4•2H 2O)制备CO:
H 2C 2O 4•2H 2O  CO↑+CO 2↑+3H 2O
CO↑+CO 2↑+3H 2O
已知:常压下,草酸晶体的熔点为101℃.比较草酸晶体的熔点和分解温度,分析若选用图装置Ⅲ制备装置Ⅰ所需的CO,可能存在的问题是 。
学生在实验室中选用如图4所示装置制取气体,请你根据所学的知识回答下列问题。
(1)写出图中标号①的仪器名称:。
(2)若用
装置制取氧气,其试管口须略向下倾斜的原因是。
(3)写出用石灰石和稀盐酸制取二氧化碳的化学方程式:。组装一套发生与收集二氧化碳的装置,应选用上图中的和(填字母)。
请你用已经掌握的实验室有关气体制取和净化等知识回答下列问题:
⑴写出上图中
、
仪器名称:
,
。
⑵实验室用高锰酸钾制取氧气时,可选用的发生装置是(填装置代号),若用装置
收集氧气,如何确定气体已经收集满,实验结束时的正确操作顺序为:先后,写出该反应的化学方程式:。
⑶若用
装置收集
,则
应从导管口(填"
"或"
")通入。
⑷若用
装置收集某种气体,则该种气体应具备的性质是,试写出一个制取该种气体的化学方程式:。
⑸某课外小组的同学用上图B装置使草酸分解并用如下装置探究草酸分解的产物:

①该装置中,
的作用是,
的作用是,
(填"能"或"不能")互相交换。
②实验观察到
处无水硫酸铜变蓝,
和
处澄清石灰水都变浑浊,
处澄清石灰水无浑浊现象,
处黑色粉末变成红色,说明草酸分解的产物是。
以下是实验室常用部分仪器:
(1) 指出图中仪器的名称:④;
(2) 小李同学选择仪器制取并收集氧气,已知他使用了仪器①③⑤⑥,那么他还需要使用上图仪器中的(填序号);该发生装置检查气密性的方法是:把导管的一端浸在水里,用手紧贴试管外壁,若导管口有,则说明该装置不漏气。
(3)小张同学正在收集一瓶CO2, 不知是否收集满了,其验满方法是。
(4)某兴趣小组选用上述仪器,用锌粒和稀硫酸制氢气,锌粒反应完后,发现还有较多的灰黑色固体物质,从反应后的混合物中分离得到该灰黑色固体的操作方法是。
【提出问题】灰黑色固体物质的成分是什么呢?
【提出猜想】①可能含有单质碳;②可能含有单质铜;③可能还有其它物质
【设计实验】请设计实验用化学方法证明该灰黑色固体物质中是否含有单质碳和单质铜。
完成下表(不一定要填满):
| 步骤 |
实 验 方 法 |
现 象 和 结 论 |
| 1 |
||
| 2 |
||
| 3 |
【反思讨论】上述各步反应完全后,兴趣小组的同学还收集到了少量剩余黑色固体物质,为了进一步探究剩余固体物质的成分,兴趣小组的同学讨论后,认为用初中化学知识无法解决,你对下一步的探究学习活动的合理建议是:首先。
燃烧是一种发光、放热的剧烈的化学反应。认识燃烧,科学地利用和控制燃烧,使燃烧为人类服务是十分重要的。
[查阅资料]物质燃烧一般需要同时满足三个条件,物质具有可燃性是燃烧的首要条件,发生燃烧的另外两个条件分别是;。
[实验目的]验证木炭发生燃烧的另外两个条件中,缺少任何一个条件都不能燃烧(两个条件须分别验证)。
[实验设计与操作]下面是验证燃烧条件的实验装置图(可通过开启、关闭活塞控制液体)。
在完成气密性检查后加入药品,并已设法在整个装置中充满了氮气。若要求实验过程中不得拆、装仪器,请设计后续的实验步骤,并按要求填表。
| 步骤 |
操作 |
预计现象及得出的结论 |
| ① |
在活塞关闭的状态下,点燃酒精灯加热 |
|
| ② |
盖灭酒精灯,待仪器恢复到常温 |
|
| ③ |
||
| ④ |
[反思评价]实验过程中,装置B的作用可能是
过氧化氢(化学式
)溶液在
作催化剂的条件下能迅速分解生成
和
,分液漏斗可以通过调节活塞控制液体的滴加速度。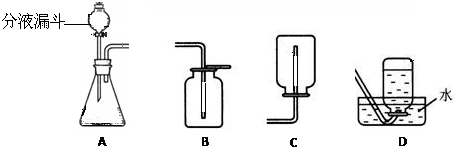
回答下列问题:
(1)分液漏斗中应放入的物质是,锥形瓶中应放入的物质是。
(2)写出该方法制取
的化学方程式;要收集一瓶较纯净的
,应选择装置(填字母)。
(3)某同学在观察到锥形瓶内有大量气泡时,开始用B装置收集
,过一段时间后,用带火星的木条伸到瓶口,看到木条,表明已收集满。
(4)若实验时用此法代替
加热制取
,优点是(填编号)。
①生成物只有氧气②不需加热③需加热
(5)装置A中反应很剧烈,据此提出实验安全注意事项是(填编号)。
①控制液体的滴加速度②用体积较小的锥形瓶③加热反应物
(6)写出用装置A制取另外2种气体的化学式和。