室温为25℃时,某小组用无水氯化铜粉末制备氯化铜大晶体,制备过程如下:
步骤I:查阅资料,得到氯化铜溶解度数据如下
温度(℃) |
0 |
20 |
25 |
40 |
50 |
60 |
80 |
溶解度(g) |
69.2 |
74.5 |
76.4 |
81.8 |
85.5 |
89.4 |
98.0 |
步骤Ⅱ:配制少量CuCl 2热饱和溶液,冷却结晶,得到晶种。
步骤Ⅲ:把晶种悬挂在新配制的CuCl 2热饱和溶液中,室温下静置数天,形成大晶体。
步骤Ⅳ:取出大晶体,处理剩余的溶液(母液)。
根据以上信息,回答下列问题:
(1)用20mL蒸馏水(密度约为1g/mL)配制50℃的氯化铜饱和溶液。
①计算需称取CuCl 2的质量是 g。
②将称取的CuCl 2固体和20mL水倒入烧杯中, (填操作名称),直至固体完全溶解。
(2)母液中Cu 2+属于重金属离子,随意排放将导致环境污染。下列方法可用于母液处理的是 。
A.收集母液于敞口容器中,用报纸包住容器口,待水分自然蒸干后保存所得固体
B.向母液中加入适量AgNO 3,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
C.向母液中加入适量NaOH,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
(3)若用铁粉置换出母液中的铜,100g母液需要铁粉的质量至少是 g(只列计算式,已知CuCl 2的相对分子质量为135)。
化学是一门以实验为基础的科学,请结合下列装置图回答相关问题。

(1)仪器a的名称是 。
(2)实验室常用高锰酸钾制取氧气,其反应的化学方程式为 ,可选用的发生和收集装置是 (填字母编号)。
(3)实验室常用大理石和稀盐酸反应制取二氧化碳,其反应的化学方程式为 ,可以用E装置来收集,验满的方法是 。
(4)适合用D装置收集的气体必须具备的性质是 。
为探究酸、碱、盐的化学性质,某兴趣小組做了如下实验。

试回答下列问题
(1)试管A中的现象是 。
(2)试管B中反应的化学方程式为 。
(3)甲同学把反应后的C、D试管中的废液倒入一只洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成;过滤后得到白色沉淀和无色滤液。甲同学欲探究无色滤液中溶质的成分。
[提出问题]无色滤液中的溶质是什么?
[作出猜想]
猜想I NaCl
猜想I I NaCl和CaCl 2
猜想ⅢNaCl 和Na 2CO 3
猜想IV:NaCl、CaCl 2和Na 2CO 3
小明认为猜想IV定不成立,其原因是 (用化学方程式表示)。
[进行实验]
|
实验步骤 |
实验现象 |
实验结论 |
|
i.取少量滤液于试管中,滴加少量碳酸钠溶液 |
无明显现象 |
猜想 成立 |
|
ⅱ.取少量滤液于试管中,滴加少量 |
有气泡产生 |
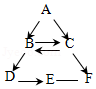
A一F为初中化学中常见的六种物质,其中B能供给呼吸,C是人体中含量最多的物质,D是黑色固体,E溶液呈蓝色,它们之间存在如图所示的转化关系(“一”表示相连的两种物质之间可以发生反应,“→”表示一种物质可以转化为另一种物质,反应条件、部分反应物和生成物已略去)。
请回答下列问题:
(1)B生成D的反应属于 反应(填基本反应类型)。
(2)写出A→B反应的化学方程式 。
(3)写出C→F反应的化学方程式 。
某学习兴趣小组研究发现铜锈[Cu 2(OH) 2CO 3]在加热后,除有CO 2和水蒸气产生外,在试管的底部还有黑色的粉末生成,他们通过实验研究了黑色粉末的成分和所产生的气体。请填空。
(1)提出问题:黑色粉末是什么?
(2)猜想:黑色粉末可能是:
a.炭粉 b.氧化铜 c.
(3)查阅资料:炭粉和氧化铜均为黑色粉末,其中炭粉不与稀硫酸反应,也不溶于稀酸,而氧化铜可与稀酸反应而溶解。写出氧化铜和稀硫酸反应的化学方程式: 。
(4)设计实验方案:向试管中的黑色固体滴加足量的 (填"化学式")溶液,充分反应后,观察固体的溶解情况和所得溶液的颜色。
(5)现象与结论:
如果猜想a正确,则现象为 ;若现象是 ,则猜想b正确;假如现象为 ,则猜想c正确。
盐酸可以除铁锈。
(1)将一根生锈的铁钉放入足量的稀盐酸中,观察到铁锈逐渐消失,溶液由无色变成 ,该反应的化学方程式为 ,其基本反应类型为 。一段时间后,又观察到铁钉表面有气泡产生,该反应的化学方程式为 。
(2)写出一种防止铁制品锈蚀的方法 。