课堂上,老师取20g蔗糖放入小烧杯中,加少量水使它润湿,注入10mL浓硫酸,搅拌,同学们看到蔗糖先变黑后“发酵”形成“黑面包”,同时还闻到了刺激性气味,同学们判断黑色固体是碳,原因是浓硫酸具有强 .
形成“黑面包”的主要原因是什么?在老师的指导下,同学们开展了探究活动.
【猜想与假设】浓硫酸与碳反应,生成大量气体使黑色固体膨胀.
【查阅资料】
Ⅰ.浓硫酸与碳在加热条件下反应,生成物中有SO2、CO2两种气体.
Ⅱ.SO2是一种具有刺激性气味的气体,能与Ca(OH)2溶液反应生成白色沉淀.
Ⅲ.SO2能使品红溶液褪色,而CO2不能.
【实验探究】
为验证碳与浓硫酸在加热条件下生成的气体产物,同学们在老师指导下设计并进行如图实验:
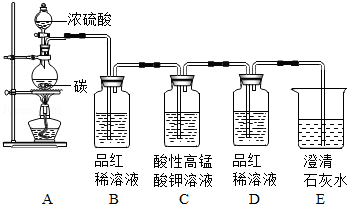
【事实与结论】
(1)请将能得出对应结论的实验现象填入表中.
验证气体 |
实验现象 |
实验结论 |
SO2 |
|
有SO2产生 |
CO2 |
|
有CO2产生 |
(2)碳与浓硫酸反应的化学方程式是 .
(3)浓硫酸与碳在加热条件下产生大量的SO2和CO2,使黑色固体膨胀,形成“黑面包”,猜想成立.
【反思与交流】
(1)小明同学提出,因老师的演示实验没有进行加热,所以同学们的探究实验无意义,其他同学一致否定了他的说法,理由是 .
(2)若B、E中试剂交换, (填“能”或“不能”)得出有CO2产生的结论,理由是 .
(3)C中酸性高锰酸钾溶液的作用是 .
实验是进行科学探究的重要方式,某同学设计如图所示实验,探究二氧化碳的有关性质。请填空:
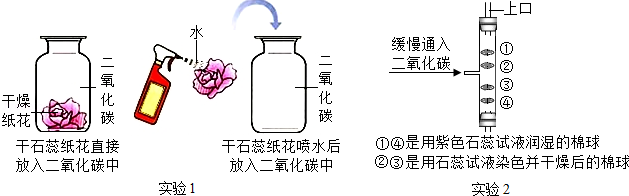
(1)实验1采用科学探究中的控制变量法,该实验控制的变量是 。
(2)实验1中干石蕊纸花喷水后放入二氧化碳中,观察到的现象是 ,该反应的化学方程式是 。
(3)实验2是在实验1的基础上设计的创新改进实验,将二氧化碳缓慢通入竖直放置的玻璃管中,能观察到第 (填序号)号棉球先变色,通过此现象可获得关于二氧化碳的另外一条性质是 。
元素的性质与原子结构密切相关,请填空:
(1)氟元素(F)的原子结构示意图如图所示,据图可判断出x的数值为 ;氟原子在化学反应中易 电子(填“得”或“失”),所以氟元素在化合物中的化合价通常为 价.
(2)氢元素与氟元素形成的化合物为氟化氢,其化学式为 2)是一种气体,能与水反应生成氟化氢和氧气,此反应的化学方程式为 .
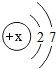
酸奶是日常生活中常见的一种食品,如表是某酸奶外包装上标识的营养成分表.
|
项目 |
能量 |
蛋白质 |
脂肪 |
糖类 |
钠 |
|
每100g |
329kJ |
2.6g |
3.1g |
10.0g |
60mg |
请填写下列空格:
(1)酸奶中的 在消化道内会逐渐被分解成可被人体吸收的多种氨基酸.
(2)脂肪在人体内分解、氧化释放出能量的过程,是将 能转化为热能.
122211)是酸奶中的一种糖类物质,蔗糖的组成中碳、氢元素的质量比为(最简整数比) .
(4)在选择制作酸奶包装盒的材料时,从化学性质的角度分析该材料应具备 的特点(填写一条即可)
根据下列装置,回答问题:

(1)写出图中标号仪器的名称:① ;② .
(2)实验室用过氧化氢溶液和二氧化锰制取氧气时,发生反应的化学方程式为 ,从控制反应速率和节约药品的角度考虑,发生装置最好选用 (填装置序号).
(3)因为氧气不易溶于水,所以可以利用装置 (填装置序号)收集,如果要做铁丝在氧气中燃烧的实验,用这种装置收集氧气时应注意 .
碳及其化合物与人类关系密切,在生活中应用广泛,请填写下列空格:
(1)下列含碳元素的物质:①碳酸钠 ②甲烷 ③一氧化碳 ④碳酸,属于有机物的是 (填序号,下同),汽水中含有的一种酸是 .
(2)木炭可以做燃料,它在空气中充分燃烧的化学方程式是 .
(3)倡导“低碳”生活,主要是为了减少 的排放量,请写出一例符合这一主题的做法 .