我市沿海地区大量养殖贝类海产品,贝壳中含有的碳酸钙是重要的工业原料。为了测定某种贝壳中碳酸钙的含量,取贝壳样品25.0g放入烧杯中,分五次加入稀盐酸,每次充分反应后称量(杂质不与稀盐酸反应),所加入稀盐酸的质量与烧杯中物质的质量的关系如下表:
加入稀盐酸的总质量(g) |
25.0 |
50.0 |
75.0 |
100.0 |
125.0 |
烧杯中物质的总质量(g) |
47.8 |
70.6 |
93.4 |
116.2 |
141.2 |
计算:
(1)当加入盐酸的总质量为50.0g时,充分反应后生成的气体质量是 g。
(2)该贝壳样品中碳酸钙的质量分数。
甲醛是室内装修的隐形杀手,甲醛的化学式为CH2O。
⑴甲醛中碳、氢、氧的质量比为; ⑵甲醛中碳元素的质量分数为。
某同学用过氧化氢溶液和二氧化锰制取氧气,化学方程式为:
,该同学将50g过氧化氢溶液和1 g 二氧化锰混合,完全反应后,称量剩余的混合物质量为49.4g。
求:(1)反应产生氧气的质量是g。
(2)该同学所用过氧化氢溶液的溶质质量分数是多少(列式计算)?
现称取变质的氢氧化钠样品10g,配制成溶液,再向其中加入CaCl2溶液(反应的化学方程式为:Na2CO3+CaC l2 = CaCO3↓+2NaCl)。反应时CaCl2溶液与沉淀的质量关系如图所示。请解决以下问题:
l2 = CaCO3↓+2NaCl)。反应时CaCl2溶液与沉淀的质量关系如图所示。请解决以下问题: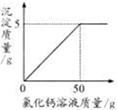
(1)计算样品中NaOH的质量;
(2)计算所加CaCl2溶液的溶质质量分数;
(3)恰好完全反应时烧杯中溶液的pH______7(选填“>”、“<”或“=”)
取黄铜屑(铜锌合金)32.5g,放入盛有180g稀硫酸(足量)的容器中充分反应,生成氢气0.4 g。试计算(请写出解题过程):
(1)该黄铜屑中铜的质量。
(2)反应后的溶液蒸发掉多少克水后可变成20%的硫酸锌溶液?
已知烧杯中装有200g硫酸和硫酸锌混合溶液,其中含硫酸锌12.1g。向烧杯中逐渐加入锌粒,放出气体质量与加入锌粒质量的关系如图14所示。当恰好完全反应时,所得的溶液为不饱和溶液。
请计算:
(1)m的值。
(2)原混合溶液中
的质量分数。
(3)恰好完全反应时,所得溶液中溶质的质量分数