兴趣小组在课外实验中意外发现:将镁条放入Na2CO3溶液中,快速产生较多气泡,有白色沉淀生成。小组同学对此进行了系列探究活动。
探究1:反应产生的气体是什么?
[作出猜想] 小组同学经查阅资料和讨论,根据化学变化过程中元素不变,且反应物中含有 三种元素,作出如下猜想:
①氢气;②二氧化碳;③氢气和二氧化碳。
[实验1]取适量镁条、100 mL Na2CO3溶液于反应装置A中,按如图1所示方案进行实验,B中石灰水不变浑浊;C处气体燃烧,烧杯内壁有水珠。说明猜想①正确。

(1)反应装置A应选用图2中的 (填写序号)。
(2)小组同学讨论认为,上述实验中“烧杯内壁有水珠”作为“反应产生的气体是氢气”的证据不可靠。为使这一证据可靠,且仍能一次性地验证三个猜想,只需在图1所示方案的基础上加以改进完善。你的改进方案是 。
探究Ⅱ:快速产生气体的原因是什么?
[查阅资料]镁与水缓慢反应生成氢气:Na2CO3溶液显碱性,其溶液中除Na+、CO32﹣外,还有OH﹣。
[作出猜想]可能是Na2CO3溶液中的某一种离子促进了镁与水的反应。
[实验2]按图3所示方案进行实验。G、I中缓慢产生气泡,H中快速产生较多气泡,说明是CO32﹣而不是Na+、OH﹣促进了镁与水的反应。

(1)G中实验的作用是 。
(2)试剂X是 。
探究Ⅲ:反应产生的白色沉淀中是否含有MgCO3?
[实验3]取实验1反应生成的沉淀于试管中,加入试剂Y,根据实验现象说明白色沉淀中含有MgCO3.试剂Y及实验现象为 ,该反应的化学方程式为 。
反思交流:有些伟大的发现就是从异常现象中得到启发,通过深入研究而实现的。
分类是学习和研究物质及变化的常用方法。将氯化钾、氮气、氢氧化钾、硝酸、三氧化硫五种物质分类,填写在对应的位置上(写化学式)。
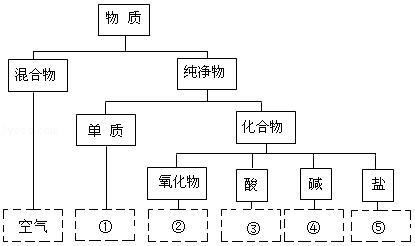
① ② ③ ④ ⑤
化学就在我们身边。从①熟石灰②金刚石③氯化钠④干冰四种物质中,选择适当的物质填空(填序号)。
(1)用于炒菜调味的是 ;
(2)用于人工降雨的是 ;
(3)用来裁玻璃的是 ;
(4)来改良酸性土壤的是 。
化学是在分子、原子层次上研究物质的科学。
(1)构成物质的粒子有分子、原子和 。
(2)如图为三种元素的原子结构示意图。
①氧原子在化学反应中容易 电子 (填“得到”或“失去”)。
②二氧化硫和二氧化碳都能与氢氧化钠溶液反应生成盐和水,将二氧化硫气体通入氢氧化钠溶液中生成亚硫酸钠(Na2SO3) 和水,写出该反应的化学方程式 。
③硒元素能增强人体免疫力,延缓衰老,山药等食物中常含硒元素。硒(Se)在氧气中燃烧生成二氧化硒。回答下列问题:
A.硒原子的核电荷数为 。
B.硒元素与氧、硫元素的化学性质相似,原因是它们的原子 相同。
C.写出硒在氧气中燃烧反应的化学方程式 。

生活离不开水,我们可以从组成、结构、性质等角度认识水。
(1)组成:如图所示电解水的实验中,试管a、b中产生气体的体积比约为 ,该实验证明水是由 组成的。
(2)结构:每个水分子是由 构成的。
(3)性质:水能与许多物质发生化学反应,写出水与氧化钙反应的化学方程式 。

化学就在我们身边,一些物质在生产生活中有重要的用途。现有①二氧化碳 ②活性炭 ③氮气 ④熟石灰 ⑤硝酸钾⑥不锈钢,选择适当的物质填空(填序号)。
(1)可用于冰箱除味剂的是 ;
(2)绿色植物进行光合作用吸收的是 ;
(3)与硫酸铜溶液混合可配成波尔多液的是 ;
(4)可充入食品包装袋中以防腐的是 ;
(5)可用于制造炊具的是 ;
(6)属于复合肥料的是 。