化学实验是科学探究的重要手段。
(1)某化学小组用图1装置制取氧气。
①A中发生反应的化学方程式为 。
②用A装置制取氧气时,长颈漏斗下端浸没在液面以下的原因是什么?
③若用B装置收集氧气,请将B装置中导管补画完整。若氧气已收集满,可观察到什么实验现象?
(2)已知甲酸(HCOOH)具有挥发性,在热的浓硫酸中分解生成一氧化碳和水。用图2微型实验装置制取CO,然后用CO还原Fe3O4,并检验气体产物。

①氢氧化钠固体的作用是 。
②写出B中Fe3O4发生反应的化学方程式。
③C中观察到的实验现象是什么?
(3)将20 g 碳酸钙加入到盛有100 g稀盐酸的烧杯中,反应后烧杯中有固体剩余物,且固体剩余物和溶液的总质量为115.6 g(气体的溶解忽略不计)。试计算反应前稀盐酸中溶质的质量分数。
小杨在实验室做酸碱盐的性质实验时发现,一瓶标注氢氧化钠溶液的试剂瓶是敞口放置的。为了检验这瓶氢氧化钠溶液是否变质,小杨与同组的另两位同学共同探究:
(1)他们依据所学的化学知识,对这瓶溶液的成分作了如下猜想:
猜想一:可能是NaOH溶液;
猜想二:可能是Na2CO3溶液,作出此猜想的理由是 。
猜想三:可能是 。
(2)查阅资料得知:Na2CO3溶液能使酚酞溶液变红,CaCl2溶液、BaCl2溶液呈中性。为了验证溶液中是否含有Na2CO3,三位同学各取少量待测试剂于小试管中,分别滴加①酚酞溶液、②稀盐酸、③澄清石灰水,并依据产生的实验现象得出相同结论:溶液中一定含有Na2CO3.你认为他们所选试剂正确的是 (填字母代号)。
A.①②③
B.①②
C.②③
D.①③
(3)为了验证“猜想二”正确还是“猜想三”正确,他们又做了以下实验:①取少量待测试剂于试管中,滴加足量 溶液,溶液变浑浊;②过滤;③在滤液中滴加酚酞溶液,变红,所以 (填“猜想二”或“猜想三”)正确。如果在已经变红的溶液中逐滴加入稀盐酸,观察到的实验现象是 。
如图是实验室制取气体的部分装置,请根据实验装置回答问题:

(1)图中标号仪器的名称是:① ,② 。
(2)用A装置制取氧气的化学方程式为: 。
(3)实验室既可以制取CO2、又可以制取O2的发生装置和收集装置组合为: (在A﹣E中选择)。
(4)实验室通常用澄清的石灰水检验CO2,写出此反应的化学方程式: 。
(5)若用F装置收集一瓶干燥的某气体,则该气体可能是 (填字母代号)。
A.H2
B.CO2
C.O2
小华同学发现自家的水壶用久以后底部会附着一层白色固体,查阅资料后得知,水在加热或长久放置时,溶于水中的可溶性钙和镁的化合物会生成沉淀(水垢),于是他邀请同学小雪进行了以下实验探究。
探究一:自家的井水是软水还是硬水?
取少量井水样品于试管中,加入 ,振荡,出现大量浮渣,由此得出结论:自家的井水属于 。
探究二:白色固体的主要成分是什么?
[假设与猜想]猜想Ⅰ:CaCO3。
猜想Ⅱ: (填化学式)。
猜想Ⅲ:CaCO3和Mg(OH)2。
[实验与探究]取少量白色固体样品(不考虑杂质和微溶物对实验的影响)于试管中,向其中加入足量稀盐酸,白色固体溶解,有 产生,根据以上现象,小华认为:猜想Ⅰ正确。小雪认为小华的结论不严谨,理由是 。经过两人反复讨论,进一步设计了如下实验。
|
实验步骤 |
实验现象 |
实验结论 |
|
取上述实验中的上层清液于试管中,滴加足量NaOH溶液 |
无明显现象 |
猜想Ⅰ成立 |
|
|
猜想Ⅲ成立 |
[拓展与迁移]取含有MgCl2和HCl的混合溶液165.8g于烧杯中,向其中缓慢加入200g溶质质量分数为8%的NaOH溶液,恰好完全反应后过滤得到沉淀和滤液,其中滤液的质量为360g。请计算:
(1)生成沉淀的质量是 克。
(2)原混合溶液中,MgCl2的质量是多少?(请写出具体的计算过程,下同)
(3)恰好完全反应时,所得溶液的溶质质量分数是多少?(结果保留至0.1%)
实验是学习化学的一条重要途径。请回答问题:
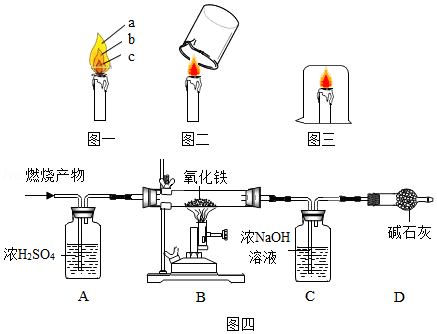
(1)如图一,观察到蜡烛燃烧时火焰分为a、b、c三层,其中温度最高的是 (填字母序号)。
(2)如图二,取一个冷而干燥的小烧杯罩在火焰上方,观察到烧杯内壁出现 ,快速倒转烧杯,倒入少量澄清石灰水,振荡,观察到澄清石灰水变浑浊。由此可知,蜡烛燃烧后的产物一定有H2O和 (填化学式)。
(3)如果用一个大烧杯扣住蜡烛(如图三),一段时间后,观察到蜡烛熄灭,说明燃烧需要 。
(4)为测定某有机物的组成(如图四),往装置中先通入一段时间干燥的氮气,再将6.4g样品在氧气中燃烧后的产物(样品无剩余)依次通过装置A、B、C、D(装置中涉及的每步反应均反应完全),结果发现装置A增重7.2g,装置C增重8.8g。试分析:
①装置A中利用了浓硫酸的 。
②装置B中红色粉末变成黑色的原因是 (用化学方程式表示)。
③装置C中反应的化学方程式为 。
④由此可知,该有机物化学式中碳、氧原子的个数比为 (填最简整数比)。
根据下列实验装置图回答问题:

(1)写出图中仪器①的名称 。
(2)若用加热高锰酸钾的方法制取较纯净的氧气,选择发生和收集装置的组合是 (填字母序号),当导管口 时,开始收集气体。若选择A装置制取氧气,其反应的化学方程式为 。
(3)实验室制取二氧化碳的化学方程式为 ,发生装置选择G的优点是 。
(4)某同学若选择F装置收集二氧化碳,检验二氧化碳已收集满的方法是:将燃着的木条放在 (填“a”或“b”)导管口,若木条熄灭,则已收满。
(5)若要证明制取二氧化碳实验后的废液呈酸性,不能选用的试剂是 (填字母序号)。
A.酚酞溶液
B.紫色石蕊溶液
C.碳酸钠
D.锌粒