铜是一种常见的金属,在生活、生产中有广泛的应用.
(1)电气工业上常用铜作电缆的内芯,是利用铜具有良好的 性;
(2)铜是一种不活泼的金属,但铜制品长期露置在潮湿空气中,表面变绿色,即生成了"铜绿"[化学式:Cu x(OH) yCO 3].
小明和小丽为了探究"铜绿"的组成,查阅资料:"铜绿"受热易分解生成CuO、CO 2和H 2O.他们进行如下实验:称取22.2克"铜绿",充分加热至固体质量不再改变,把产生的气体全部依次通过足量浓硫酸和足量氢氧化钠的溶液,发现浓硫酸增重1.8克,氢氧化钠溶液增重4.4克.
根据以上实验.他们推断出:x= ,y= ;铜与潮湿空气中变成"铜绿"的化学方程式是 ;
(3)小明和小丽分别取24.0克氧化铜,用CO还原制铜,小明得到19.2克红色固体,小丽得到20.8克红色固体.他们质疑:为什么两人得到的红色固体质量不相等?
查阅资料:
Ⅰ.CO还原CuO时也可产生红色的氧化亚铜(Cu 2O)
Ⅱ.Cu 2O+H 2SO 4(稀)═Cu+CuSO 4+H 2O
他们分析推断:
①一致认为 (填"小明"或"小丽")的产物中没有Cu 2O;
②用CO还原a克Cuo得到红色固体b克,若红色固体为Cu和Cu 2O的混合物,则a与b的数量关系是 ;
③还可以简单的实验验证红色固体是否有Cu 2O,请简述操作、现象及结论: .
在美丽的葫芦岛,让我们感受一下"化学生活"吧!
(1)葫芦岛有绵长的海岸线,盛产鱼虾贝类等海产品,这些美味给我们提供的主要营养素是 .
(2)葫芦岛海滨有一条十多里长掩映在绿树丛中的木栈道,走在栈道上时常看到"注意台阶"、"保持卫生"等提示,你认为还应该有的一个安全提示是 .
(3)泳装已成为兴城的又一个城市标签,制作泳装的面料是锦纶和氨纶,它们属于 (填字母)
A.塑料 B.合成纤维 C.天然高分子材料
(4)葫芦岛城市居民家庭主要能源之一是管道天然气,天然气充分燃烧的化学方程式是 .
金属材料的研究和应用是化学学习的一个重要内容。
(1)利用铝的 性可将铝块制成铝箔。
(2)工业上用一氧化碳还原赤铁矿冶炼金属铁的化学方程式为 。
(3)因生铁和钢的 不同,导致它们在性能上有很大差异。
(4)验证铝、铜、银的活动性顺序时,除铝、银外还需要用到的一种试剂是 ,除此之外,还可以通过它们与氧气反应的 比较它们的活泼性。
冰晶石在农业上可用以制杀虫剂,其化学式为Na3AlF6,请回答:
(1)冰晶石的相对分子质量为 .
(2)冰晶石中钠元素、铝元素的质量比是 (填最简整数比).
如图是氢气和氧气发生反应的微观模拟图,请回答下列问题:
(1)在A图中将相关粒子图形补充完整。
(2)此变化的微观实质是:在点燃条件下,氢分子分解成氢原子,氧分子分解成氧原子, 。
(3)在元素周期表中,某元素比氢元素多2个周期多2个族,与该元素化学性质关系最密切的电子数目为 。

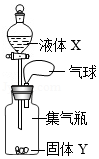
如图是某趣味实验装置图,按要求回答下列问题:
(1)若X为过氧化氢溶液,Y为二氧化锰。则可观察到什么现象?并用化学方程式表示产
生该现象的原因 。
(2)请再列举出可产生相同现象的一组药品 。