为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①、②、③、④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:
样品编号 |
① |
② |
③ |
④ |
稀盐酸的质量 |
25g |
50g |
m(80<m<150) |
150g |
剩余固体的质量 |
7.5g |
5g |
2g |
2g |
然后,为了探究石灰石与稀盐酸反应后所得溶液中的溶质成分,将编号③所得溶液过滤,取滤液质量的  于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关的变化如图所示:
于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关的变化如图所示:
分析题中有关信息和图表,回答下列问题:
(1)该石灰石样品的纯度为 .
(2)编号③所用稀盐酸的质量m为 g.
(3)A点处对应的溶液中溶质的质量分数是多少?(写出计算过程)

(6分)实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示。回答下列问题: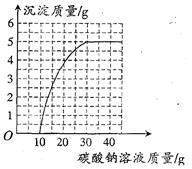
(1)从图中看出生成沉淀的最大质量是g;
(2)开始加入碳酸钠溶液至10g时,还没有沉淀析出的原因是;
(3)加入碳酸钠溶液至40g时,溶液中的溶质是;
(4)计算原滤液中氯化钙的质量分数。
华雪同学想测定某
合金中两种金属的质量比。称取这种合金
,加入足量
溶液充分反应后过滤,将所得固体洗涤、干燥后称量,质量为
。
(1)发生反应的化学方程式为。
(2)试计算该合金中铜与银的质量比。(请写出计算过程)
(3)华雪同学认为还可算出该AgNO3溶液中溶质的质量分数,于是进行了多次实验,记录了每次使用
溶液的质量
(
溶液)和充分反应后所得固体的质量
,并绘制了下图,则
溶液中溶质的质量分数是多少?(请写出计算过程,用含
的代数式表示)
化学实验室现有质量分数为98%的浓硫酸,但在实验室中常需要用较稀的硫酸。请回答下列问题:
(1)上述浓硫酸中溶剂的质量分数是。
(2)要把50g上述浓硫酸稀释为质量分数为10%的硫酸,需要水的质量是多少?(请写出计算过程)
某同学向过氧化氢溶液中加入二氧化锰制取氧气,相关数据如下:
| 反应前物质的质量/g |
充分反应后物质的质量/g |
|
| 过氧化氢溶液 |
二氧化锰 |
固体与液体混合物质量 |
| 68.0 |
0.1 |
66.5 |
请计算:
(1)该同学制得氧气的质量为。
(2)该同学所用过氧化氢溶液的溶质质量分数。(相对原子质量:
-1
-16)
某石灰水中含有氢氧化钙 ,如果该石灰水吸收二氧化碳完全反应变成白色沉淀,则可以吸收二氧化碳的质量是多少()?