化学与药品研发
2015年屠呦呦因发现青蒿素并成功研制出抗疟新药,成为我国本土第一位诺贝尔生理学或医学奖得主.我国的许多医学著作中都有使用青蒿治疗疟疾的记载,屠呦呦团队通过研究,发现了青蒿素.确定了它的组成、结构,并成功合成.
(1)提取过程
研究人员先是采用水煎法(将青蒿放入水中,加热煮沸、浓缩),发现得到的提取物对疟原虫无抑制效果,而采用95%的乙醇(乙醇沸点78℃)为溶剂进行提取,得到的提取物有效率为30%﹣40%,后来又采用乙醚(沸点35℃)为溶剂,得到的提取物有效率达到95%以上,课题组将提取物中的有效成分命名为青蒿素.
根据青蒿素的提取过程推测青蒿素的物理性质和化学性质(各写一条) 和 等.
(2)结构分析
确定中草药成分的化学结构是药物研制过程中十分重要的一环,在成功分离出青蒿素晶体后,课题组立即着手分析其化学结构.
①定性分析
取适量青蒿素,在氧气中充分燃烧,测得生成物只有二氧化碳和水,由此推断青蒿素中一定含有的元素是(用符号表示) .
②定量分析
实验测得青蒿素的相对分子质量是282,其中碳元素的质量分数是63.8%,氢元素的质量分数是7.8%,根据以上信息,写出确定一个青蒿素分子中氧原子个数的计算式(只列式,不计算结果) .
③主要抗疟结构分析
青蒿素对疟原虫有很好的抑制作用,可能是因为它有较强的氧化性,青蒿素分子中具有怎样的结构才使它有较强的氧化性呢?
我们熟悉的过氧化氢溶液有较强的氧化性,医疗上常用它杀菌消毒,过氧化氢分子中原子间相互结合的方式有"H﹣O﹣、﹣O﹣O"两种,青蒿素分子中原子间相互结合的方式有"  、H﹣O﹣、﹣O﹣O﹣"等几种,你认为青蒿素分子中起杀菌作用的原子间相互结合的方式是 .以上是运用已有知识进行的推理,推理是否正确,需要通过 进行验证.
、H﹣O﹣、﹣O﹣O﹣"等几种,你认为青蒿素分子中起杀菌作用的原子间相互结合的方式是 .以上是运用已有知识进行的推理,推理是否正确,需要通过 进行验证.
(3)化学合成
青蒿中青蒿素的含量只有0.1%﹣1%,课题组于1984年成功合成了青蒿素,请你谈一谈化学合成青蒿素有哪些优点(答一点即可) .
某金属冶炼厂在生产过程中产生了一定量的含铜废料。化学兴趣小组利用稀硫酸和铁粉分离回收铜,并获得硫酸亚铁晶体。其设计方案如图1所示。
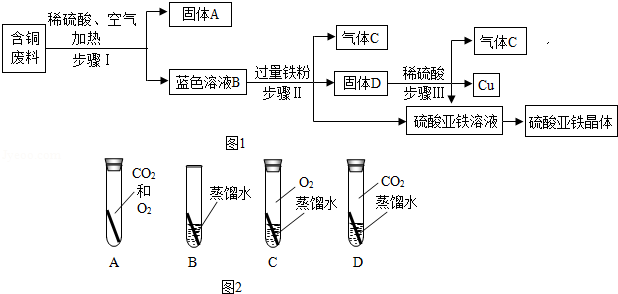
查阅资料得知:在通入空气并加热的条件下,铜可与稀硫酸反应转化为硫酸铜,反应的化学方程式:2Cu+2H 2SO 4+O 2 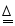 2CuSO 4+2H 2O。
2CuSO 4+2H 2O。
(1)步骤Ⅰ中分离得到固体A和蓝色溶液B的操作名称是 。
(2)蓝色溶液B中的溶质是 (填化学式)。
(3)写出步骤Ⅲ中发生反应的化学方程式 。
(4)硫酸亚铁可用作治疗 (选填"贫血症"或"佝偻病")的药物。
(5)铜制品在空气中会发生锈蚀[铜锈的主要成分是Cu 2(OH) 2CO 3].根据铜锈的主要成分中含有氢元素和碳元素,可以判断出铜锈需要空气中的 (填化学式).若要探究"铜生锈是否需要空气中的氧气?"如图2所示实验中,只需完成 (填字母)两个实验即可达到实验目的。
如图是初中化学常见气体的发生装置,根据要求回答下列问题。
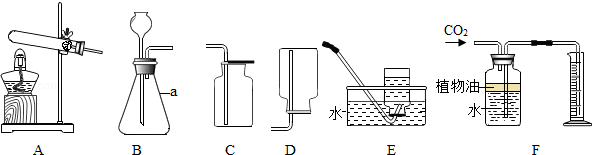
(1)仪器a的名称是 。
(2)实验室制取二氧化碳的化学方程式是 。用F来测量生成二氧化碳的体积,其中在水面上放一层植物油的目的是 。
(3)实验室用高锰酸钾制取氧气所选用的发生装置是 (填序号),该反应的基本反应类型为 。用E装置收集氧气时,观察到导管口的气泡 ,再把导管口伸入盛满水的集气瓶。
化学与生活密切相关.请回答下列问题.
(1)成语"釜底抽薪"运用的灭火原理是 .
(2)饮食均衡,身体不能健康.食用蔬菜、水果能获取的基本营养素主要是 .
(3)氢气是最清洁的能源,其原因是 (用化学方程式表示).
(4)生产中需要用15kg质量分数为16%的氯化钠溶液选种、需要氯化钠的质量是 kg.
某化学兴趣小组对胃药"碳酸氢钠片"进行了探究,具体做法如下:
Ⅰ.取1片胃药研碎,加水完全溶解得到100g溶液;
Ⅱ.配制100g 0.365%的稀盐酸作为模拟胃酸;
Ⅲ.取上述一种溶液20g于锥形瓶中,再将另一种溶液逐滴加入锥形瓶内,反应后溶液的pH变化情况如图所示。
请回答下列问题:
(1)碳酸氢钠属于 (填"酸""碱"或"盐");
(2)步骤Ⅲ中,当滴入另一种溶液的质量为10g时,锥形瓶内物质恰好完全反应(胃药中其它成分不参加反应),请根据实验数据计算每片胃药中碳酸氢钠的质量,写出必要的计算过程。

实验室用含杂质的锌与稀硫酸反应制取氢气,取8g含杂质的锌粒于烧杯中(所含杂质不溶于水,也不与酸反应),向其中加入74.2g稀硫酸,恰好完全反应后烧杯内剩余物质的质量为82g。计算:
(1)杂质的质量 g。
(2)反应后所得溶液的溶质质量分数(请写出计算过程)