合金的种类很多,用途非常广泛,黄铜是铜和锌的合金,它可以用来制造机器和电器的零件等,化学兴趣小组的同学欲测定实验室中某铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程.
称量10g粉末状黄铜样品放入烧杯中,量取45mL稀盐酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 |
第二次 |
第三次 |
|
加入稀盐酸的体积(ml) |
15 |
15 |
15 |
生成氢气的质量(g) |
0.04 |
m |
0.02 |
试求:
(1)m的数值 .
(2)此黄铜样品中铜的质量分数是多少?(写出计算过程)
某校九年级"我们爱化学"活动小组的同学,探究了过氧化钠(Na 2O 2)与二氧化硫(SO 2)反应后所得固体产物的成分,过程如下:
【查阅资料】过氧化钠与二氧化硫反应的化学方程式为:2SO 2+2Na 2O 2=2Na 2SO 3+O 2,2Na 2SO 3+O 2=2Na 2SO 4;SO 2能使品红溶液褪色。
【提出猜想】猜想1:固体成分为Na 2SO 3
猜想2:固体成分为Na 2SO 4
猜想3:
【实验探究】用如图所示的装置进行实验。打开A中分液漏斗的活塞,反应发生(产生足量的SO 2)后,用带火星的木条检验从a处导出的气体,木条复燃。实验前称得Na 2O 2固体的质量为78g,充分反应后称得生成物固体的质量为134g。
【实验结论】(1)A是制取SO 2气体的装置,反应的化学方程式与实验室制取CO 2的化学方程式类似,请写出A中发生反应的化学方程式: 。
(2)由题中 的实验现象,可推测猜想2是错误的。
(3)装置B的作用是 ;装置D的作用是 。
(4)根据反应前后固体的质量,可计算出Na 2SO 3的质量为 g,Na 2SO 4的质量为 g。
【总结提升】(1)若实验前称得Na 2O 2固体的质量为m 1g,充分反应后称得生成物固体质量为m 2g,则m 2的取值范围是 (用含m 1的关系式表示)
(2)请另外设计一种实验方案,定性验证过氧化钠与二氧化硫反应后所得固体产物的成分:

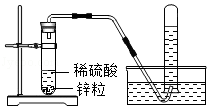
已知两种活动性不同的金属在能导电的溶液中接触可以形成原电池,从而加快化学反应速率.在实验室里,我们常用锌与稀硫酸反应来制取氢气(装置如图所示).
(1)实验室用锌与稀硫酸反应制取氢气的化学方程式为 .
(2)实验室也可用锌与盐酸反应来制取氢气,但制得的氢气中往往含有HCl气体,若将制得的气体通过盛有NaOH溶液的洗气瓶, (填"能"或"不能")得到纯净的氢气.
(3)点燃氢气之前,先要进行的操作是 .
(4)锌与稀硫酸反应时,加入某些盐溶液可使制取H 2的速率加快,如 溶液.
(5)图示装置, (填"能"或"不能",药品可换)用来制取CO 2气体.
目前,农业上使用最多的氮肥主要有尿素、硝酸铵和碳酸氢铵等,其中硝酸铵的生产原理是利用氨催化氧化得到的硝酸,再跟氨反应生产硝酸铵,基本流程如下:
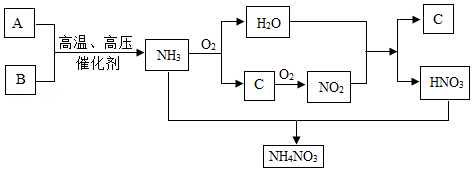
已知:①上述流程图中A、B、C均为气体,其中A、B为单质且A的相对分子质量为28,C为含有A组成元素的化合物;氨与氧气反应的条件是高温、催化剂。
②在化学反应中,只要有物质所含元素的化合价发生了变化的反应就是氧化还原反应。例如:2Na+2H 2O═2NaOH+H 2↑,反应前后,Na元素、H元素的化合价分别发生了变化,该反应是氧化还原反应。
请回答下列问题:
(1)写出A、C两种物质的化学式:A为 ;C为 。
(2)NH 3和O 2反应的化学方程式为
(3)上述流程图的5个反应中有 个属于氧化还原反应。
请用所学的知识回答下列问题:
(1)为什么沙漠地区的铁制品锈蚀较慢?
(2)用排空气法收集二氧化碳时,怎样证明集气瓶中已充满了二氧化碳?
将适量二氧化碳通入100g氢氧化钠溶液中。恰好完全反应后,得到108.8g碳酸钠溶液请计算:
(1)参加反应的二氧化碳的质量为 g;
(2)氢氧化钠溶液的溶质质量分数。