实验室有一瓶标签腐蚀的溶液A(如图),某组同学将碳酸钠溶液与样品反应,有白色沉淀产生,过滤后得到澄清滤液,同学们进行了一系列的探究。
探究一 A溶液中溶质是什么?
【提出猜想】①CaCl 2,② 。
【查阅资料】CaCl 2溶液呈中性。
【设计实验】同学们设计了如下方案并进行实验。
实验操作 |
实验现象 |
实验结论 |
取少量A溶液于试管中,向其中滴加无色酚酞溶液 |
|
猜想①正确 |
碳酸钠与其反应的化学方程式为 。
探究二 过滤后的滤液中会有哪些溶质?
【提出猜想】小明的猜想:NaCl、CaCl 2;小红的猜想:NaCl;你的猜想:
【设计实验】请设计对"你的猜想"实验:
实验步骤 |
实验现象 |
实验结论 |
|
|
你的猜想正确 |
[思维拓展]为防止标签被腐蚀,倾倒液体时应注意: 。
在小英家的仓库里,堆放着一袋袋化肥一一碳酸氢铵( NH4HCO3)。过了一个夏天,小英发现这种化肥所持有的刺激性气味变得更浓烈了,有些化肥袋里碳酸氢铵变少了,检查发现变少的化肥包装袋没有密封,化肥也没有撒落在地上,更没有人进过仓库开袋使用。
为了探究这些化肥减少的原因,小英在实验室取了一些碳酸氢铵粉末,放在蒸发皿中加热,过一会儿观察到粉末完全消失,同时也闻到了这种刺激性气味。粉末为什么会消失呢?
(1)【提出问题】碳酸氢铵粉末消失的原因是什么?
(2)【猜想】①碳酸氢铵粉末在不加热或加热条件下由固态变成它的气态。②碳酸氢铵在不加热或加热条件下发生分解反应,可能产生的物质有氨气和一些氧化物。
(3)【查阅资料】①碳酸氢铵属于氨肥,不具有升华的性质,说明上述猜想 (填序号)不成立;②氨气(化学式NH3)具有特殊的刺激性气味,极易溶于水,其水溶液是碱性,但干燥的氨气不能使干燥的红色石蕊试剂变蓝;③NO2为红棕色气体。NO为无色气体,在空气中易发生反应:2NO+O2═2NO2
(4)【实验操作,现象与结论】

|
实验操作 |
实验现象 |
实验结论 |
|
①取适量碳酸氢铵于试管中加热,如图一所示,将干燥的红色石蕊试纸接近导管口 |
产生强烈的刺激性气味,试管壁上有无色液滴且试纸变蓝,但未见红棕色气体 |
分解产物中有 ,没有 |
|
②按如图二所示装置继续实验,直到反应完全 |
澄清石灰水变浑浊 |
分解产物中有 |
(5)【应用】①利用氨气的化学性质,请写出实验室检验氨气的方法(写出实验操作、现象、结论):
②如果你家里有碳酸氢铵化肥,你应该如何保存? 。
在实验桌上有如下几种气体发生装置和收集装置。请你参与实验并回答问题:

(1)写出标号①的仪器名称: ;
(2)实验室制取二氧化碳气体的发生装置为: (填字母)
(3)用C装置收集二氧化碳,其验满的方法是: 。
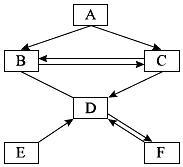
A、B、C、D、E、F六种物质均由非金属元素组成。其中D、F是组成元素相同的气体。他们存在如图所示的转化关系,“→”表示可以向箭头所指方向一步转化,“﹣”表示两种物质之间可以发生反应(反应条件与其他物质均已略去)。请回答下列问题:
(1)写出F的化学式: ;
(2)写出B→C的化学方程式: ;
我市教育主管部门为了让同学们过好传统佳节一一端午节,特意将中考提前一天。化学兴趣小组的同学们为庆祝端午佳节,决定自己动手制作传统食品一一皮蛋。制作皮蛋料泥的原料主要有:生石灰、纯碱、草木灰(含K2CO3)等。将他们按一定比例混合加入适量水得到皮蛋料泥。料泥的主要成分是什么呢?同学们进行了如图所示的探究:
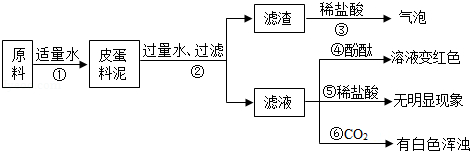
(1)步骤②的操作所需的玻璃仪器有:烧杯、玻璃棒、 ;
(2)步骤③的现象说明滤渣中一定含有的物质为: ;
(3)由上述实验现象推断,滤液中的溶质一定含有: ;
我国早在西汉时期,就有“曾青得铁则化为铜”的记载,即把铁片放入硫酸铜溶液中可以置换出铜。11.2g铁与足量的硫酸铜溶液反应,理论上可得到铜的质量是多少?