食醋中一般含有3%﹣5%的醋酸,醋酸又叫乙酸(CH3COOH),是无色有刺激性气味的液体,能溶于水.(1)食醋可以除去水壶内的水垢,水垢的主要成分之一是碳酸钙.除水垢时,可在水壶中加入水,倒入适量醋,浸泡一段时间,碳酸钙会转变成可溶性的醋酸钙而被除掉,化学方程式为:
CaCO3+2CH3COOH═(CH3COO)2Ca+H2O+CO2↑.
(2)在熬制骨头汤时,常常在汤中加入少量食醋,因为骨头中含有不溶于水的磷酸钙,当磷酸钙与醋酸作用时生成可溶于水的磷酸二氢钙,能够增加汤内的含钙量,促进人体对钙、磷的吸收和利用.
(3)食醋不仅在厨房中大显身手,还是一种杀菌剂,冬天在屋子里熬醋可以杀灭细菌,对抗感冒有很大作用.
(4)饮酒过量的人可以用食醋来解酒,因为乙酸能跟乙醇发生酯化反应生成乙酸乙酯(CH3COOC2H5)和水,从而达到解酒的目的.
(5)醋酸能与活泼的金属发生置换反应产生氢气,家用铝盆等金属制品不能用来盛放食醋,以免被腐蚀.
根据以上内容,回答下列问题:
(a)乙酸属于 (填“有机化合物”或“无机化合物”).
(b)乙酸的物理性质 (任答一条).
(c)食醋能用来解酒的原因是 .
(d)用食醋除水垢,该反应属于基本反应类型中的 反应.
(e)用铁锅炒菜时,放一点食醋能补铁的原因是 .
我国用新技术提纯了稀有金属铼(Re),为航空航天发动机核心部件的制造提供了重要原料。
(1)铼原子的相对原子质量为186,原子核内有75个质子,则其核外电子数为 。
(2)高铼酸钠(NaReO4)是铼的重要来源之一。高铼酸钠中铼元素的化合价为 。
某同学用如图装置验证质量守恒定律。称取一定质量的碳酸钠装入气球,将气球套在锥形瓶上。将药品全部倒入装有足量稀盐酸的锥形瓶中,气球迅速胀大。称量反应前后装置的总质量,实验数据如下表所示。
|
实验次数 |
1 |
2 |
3 |
|
碳酸钠质量/克 |
0.53 |
1.06 |
2.12 |
|
反应前装置总质量/克 |
66.33 |
66.86 |
67.92 |
|
反应后装置总质量/克 |
66.19 |
66.62 |
67.42 |
(1)计算第1次反应产生的二氧化碳质量。
(2)分析数据发现每次反应前后装置的总质量均不相等,请以第1次反应为例,通过计算说明该反应是否遵循质量守恒定律。(空气密度取1.3克/升,二氧化碳密度取2.0克/升,结果精确到0.01)
《中国居民膳食指南》建议成人平均每天食盐摄入量应在6克以下。据调查,我国成人平均每天食盐摄入量为10.5克。
(1)高盐饮食容易引发 。
| A. |
传染病 |
B. |
遗传病 |
C. |
心血管疾病 |
(2)人体摄入食盐后,主要在 被吸收进入血被循环。
(3)某品牌低钠盐含氯化钠70%,氯化钾30%。若某人每天摄入食盐6克,现以该低钠盐代替食盐,则每天可减少多少克钠元素的摄入?(结果精确到0.1)
2018年2月《自然》杂志上发表了一项新研究,展示了一种全新的加工木材的方法(如图),把天然木材放在NaOH和Na 2SO 3的混合液中煮沸以除去部分木质素,接着在100℃以上的高温中进行机械压缩制成致密木材。

(1)致密木材是由天然木材加工而成的,其密度为天然木材的3倍。
①加工致密木材的材料主要取自于植物的 (填植物器官名称)。
②充分压缩后木材的厚度减小到原天然木材的20%,这一过程主要是 变化。若在压缩过程中底面保持不变,则说明处理过程中木材的质量减少了 (用百分数表示)。
(2)致密木材的硬度、拉伸强度都很大,为天然木材的10倍左右,甚至超过了部分金属。
①致密木材的拉伸强度和纤维素有关。纤维素的化学式为(C 12H 10O 5)n,则其中三种元素的质量比是C:H:O= 。
②拉伸强度  ,它用来表示材料的坚韧程度。拉伸强度与我们所学的科学量 的单位是相同的。
,它用来表示材料的坚韧程度。拉伸强度与我们所学的科学量 的单位是相同的。
(3)与其他材料相比,致密木材的优点是 。
A.加工过程中没有任何污染
B.可代替部分金属材料,具有广阔的应用前景
C.原料来源丰富,能通过无限制砍伐树木加工制成
实验室有甲乙两瓶久置的氢氧化钠固体,某学习小组为了研究其变质情况,进行了如下实验:(电子秤示数单位为克)
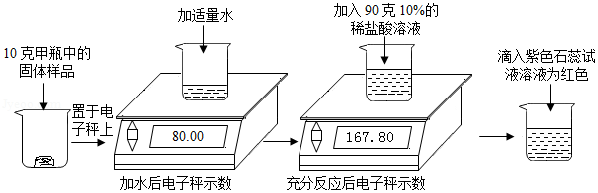
(1)滴入紫色石蕊试液后溶液为红色,说明反应后溶液呈 性。
(2)上述实验中产生的二氧化碳气体质量为 克。
(3)计算甲瓶固体样品中碳酸钠的质量分数。
(4)某同学另取10克乙瓶中的固体样品,用100克15%的稀硫酸按同样方法进行实验,他认为不管固体样品变质程度如何,稀硫酸加入后,都不需要使用石蕊试液,请计算说明他做出此判断的原因。