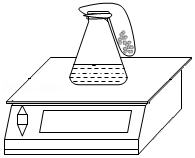
在今年化学实验操作考试“探究纯碱的性质”中,同学们做了如图所示的四组实验,并将A、B、C、D四支试管中的废液全部倒入一个干净的大烧杯中。考试结束后,某兴趣小组发现大烧杯底部有沉淀,上层溶液呈红色。为了探究上层溶液的成分,进行了以下实验。

[提出问题]大烧杯中的上层溶液中除了含有水和酚酞外,还含有哪些离子?(假设难溶物质、水和酚酞均不会解离出离子)
[猜想假设]小明认为上层溶液中一定含有Na+、CO32﹣、H+、Cl﹣、Ba2+、Ca2+、OH﹣七种离子,你认为上层溶液中含有的离子最多可能有几种,它们分别是 (填离子符号)。
[分析讨论](1)小红认为上层溶液中一定不含有H+,因为上层溶液呈红色。请你分析上层溶液中不含有H+的另外一个理由 。
(2)小李取一定量的上层溶液于试管中,滴加几滴稀盐酸,发现无气泡产生,认为上层溶液中一定不含有CO32﹣.小红认为他的结论不正确,原因是 。
[设计实验]为进一步确定上层溶液中是否含有CO32﹣,请你和小红一起参与下列探究:
实验操作 |
实验现象 |
实验结论 |
取大烧杯中上层溶液少许于一支试管中,滴加过量的BaCl2溶液,静置 |
①
②试管中的上层溶液仍是红色 |
①大烧杯中上层溶液中一定含有CO32﹣ ②同时还能得出大烧杯中的上层溶液中一定含有离子是 (填离子符号) |
[实验结论]大烧杯中的上层溶液中一定含有的离子是 (填离子符号)。
早在西汉时期的《淮南万毕术》中就记载"曾青得铁则化为铜",成为现代湿法冶金的先驱。现有含1.6kg硫酸铜的工业废液,加入铁粉回收铜,请计算:
(1)硫酸铜中铜元素的质量分数。
(2)理论上与硫酸铜反应消耗铁粉的质量。
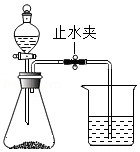
海螵蛸是一味中药,其主要成分是碳酸钙,某同学利用如图装置测定其中碳酸钙的含量。
①在锥形瓶中加入质量为m的海螵蛸粉末,向分液漏斗中加入稀盐酸。在烧杯中加入足量氢氧化钠溶液,并称量烧杯及氢氧化钠溶液总质量m 1。
②先打开止水夹,再打开分液漏斗活塞,滴加盐酸并及时关闭活塞。完全反应后,再次称量烧杯及其中液体的总质量m 2。
③利用m 2与m 1的差值,计算反应生成的二氧化碳质量,再计算海螵蛸中碳酸钙的含量。
(1)海螵蛸具有治疗胃酸过多、能为骨质发育提供重要元素的功效,其原因是 。
(2)实验前要检查装置的气密性,方法是:用止水夹夹住橡胶管,往分液漏斗中加入适量水。打开分液漏斗的活塞,观察到 ,说明装置气密性良好。
(3)下列情况会导致海螵蛸中碳酸钙质量分数测量值偏小的是 (可多选)。
A.海螵蛸中滴加盐酸过量
B,锥形瓶内部分水蒸气随二氧化碳逸出
C.反应结束后,锥形瓶内有二氧化碳残留
D.反应速度过快,大量气泡从氢氧化钠溶液中溢出
人类发现二氧化碳经历了多个世纪,下列是其历程中的部分资料。
资料一:1630年,海尔蒙特发现在一些洞穴处,有一种能使燃着的蜡烛熄灭的气体,后来被证实是CO 2。
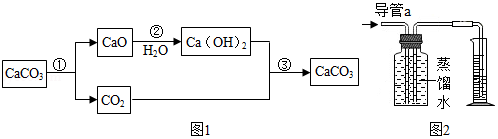
资料二:1754年,布菜克将石灰石煅烧首次制得CO 2,并完成了如图1所示的物质转化研究。
资料三:1766年,卡文迪许通过实验测得,室温下1体积水大约能溶解1体积二氧化碳气体。
(1)根据海尔蒙特的发现,可推测二氧化碳的化学性质: 。
(2)写出布莱克实验中反应③的化学方程式: 。
(3)如图2,在室温下将容积为200毫升的广口瓶注满蒸馏水,通过导管a缓慢通入300毫升CO 2。如果卡文迪许的结论是正确的,则在量筒中收集到的水约为 毫升。
我国用新技术提纯了稀有金属铼(Re),为航空航天发动机核心部件的制造提供了重要原料。
(1)铼原子的相对原子质量为186,原子核内有75个质子,则其核外电子数为 。
(2)高铼酸钠(NaReO4)是铼的重要来源之一。高铼酸钠中铼元素的化合价为 。
某同学用如图装置验证质量守恒定律。称取一定质量的碳酸钠装入气球,将气球套在锥形瓶上。将药品全部倒入装有足量稀盐酸的锥形瓶中,气球迅速胀大。称量反应前后装置的总质量,实验数据如下表所示。
|
实验次数 |
1 |
2 |
3 |
|
碳酸钠质量/克 |
0.53 |
1.06 |
2.12 |
|
反应前装置总质量/克 |
66.33 |
66.86 |
67.92 |
|
反应后装置总质量/克 |
66.19 |
66.62 |
67.42 |
(1)计算第1次反应产生的二氧化碳质量。
(2)分析数据发现每次反应前后装置的总质量均不相等,请以第1次反应为例,通过计算说明该反应是否遵循质量守恒定律。(空气密度取1.3克/升,二氧化碳密度取2.0克/升,结果精确到0.01)