实验室有一瓶常用无色液体的标签模糊了(如图)。为确定该瓶溶液的溶质是什么,同学们进行了如下探究:
[提出问题]这瓶溶液的溶质是什么?
[作出猜想]猜想1:NaOH 猜想2:Na 2CO 3猜想3:NaHCO 3猜想4:NaCl
[查阅资料]NaHCO 3溶液显碱性,NaHCO 3溶液不与CaCl 2溶液反应。
[实验探究]
实验步骤 |
实验现象 |
实验结论 |
小亮取2mL该无色溶液于试管中,滴加2滴无色酚酞溶液 |
溶液变红 |
猜想1、3成立、猜想2、4不成立 |
小丽取2mL该无色溶液于试管中,加入3mL稀盐酸 |
立即产生气泡 |
猜想 不成立 |
[交流讨论]
(1)同学们一致认为小亮的实验结论不正确,理由是 。
(2)为了确定该无色溶液到底是什么,小强继续进行如下实验:
①取2mL该无色溶液于试管中,滴加CaCl 2溶液,边加边振荡,观察到产生白色沉淀。由此得出猜想 成立,反应的化学方程式为 。
②另取2mL该无色溶液于试管中,逐滴加入稀盐酸,一段时间后才观察到有气泡产生。
[拓展思考]小丽和小强都向无色溶液中加入稀盐酸,为什么现象不同?
[延伸探究]同学们查阅资料发现:向Na 2CO 3溶液中逐滴加入稀盐酸时,反应分两步进行:Na 2CO 3+HCl═NaHCO 3+NaCl;NaHCO 3+HCl═NaCl+CO 2↑+H 2O.故出现小强的实验现象。
[应用提升]现有两瓶失去标签的无色溶液,已知它们分别是碳酸钠溶液和稀盐酸中的一种,若不另加任何试剂要将二者鉴别开,你的鉴别方案是 (写出操作方法、现象和结论)。

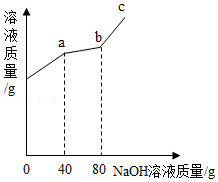
向100g硫酸铜与硫酸的混合溶液中加入溶质质量分数为10%的氢氧化钠溶液,溶液质量与所加氢氧化钠溶液的质量关系如图所示,回答下列问题:
(1)由图象可知,c点溶液中的溶质是 。
(2)当加入氢氧化钠溶液的质量为80g时,所得不饱和溶液中溶质的质量分数是多少?(结果精确到0.1%)
某小组同学在实验室研究铝与氯化铜溶液的反应,过程如下:
|
实验操作 |
实验现象 |
|
|
①铝片表面附着一层红色固体 ②铝片表面逸出大量无色气体,放出大量的热 ③烧杯底部出现红色固体和白色沉淀 |
(1)打磨铝片的目的是 。
(2)现象①③中的红色固体是同种物质,请写出现象①的化学方程式 。
(3)经检验,现象②中的无色气体为氢气。甲同学猜测可能是氯化铜溶液显酸性,经pH计检验,pH 7,证实了甲的猜想。
(4)探究现象③中白色沉淀的化学成分。
乙同学通过查阅资料认为白色沉淀可能是氯化亚铜(CuCl)。
32+﹣32+在空气中易被氧化变为蓝色。
[进行实验]①取烧杯底部的白色沉淀,充分洗涤。洗涤的目的是 。
②向白色沉淀中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份,进行实验:
|
操作步骤 |
实验现象 |
实验结论 |
|
3溶液 |
产生白色沉淀 |
该溶液中含有
|
|
Ⅱ.将另一份溶液置于空气中一段时间 |
|
32+ |
[得出结论]通过实验可以确定,该白色沉淀是CuCl。
2溶液反应为什么会出现CuCl呢。
222222溶液反应能生成CuCl,改进的方法是 ,试写出该反应的化学方程式 。
II.丁同学认为丙同学的实验还不够严谨,还应考虑 2溶液反应的影响。
金属材料在生产、生活中有广泛的应用,认识金属的性质有利于更好地利用金属。
(1)铁在初中化学实验中多次亮相,如图展示了铁钉的一系列变化。

I.变化①是铁钉与空气中的 发生了反应。
II.变化②中常见除去铁锈的化学方程式为 。
III.如表是小明同学记录的锌粉与稀硫酸反应过程中反应时间与产生气体体积的变化数据:
|
时间(min) |
1 |
2 |
3 |
4 |
5 |
|
氢气体积(mL) |
50 |
120 |
230 |
290 |
310 |
实验数据反映,该反应速率的特点是 ,引起该速率变化的原因是 。
(2)将m克锌和铁的混合物放入硝酸铜溶液中,充分反应,经过滤、洗涤、干燥后,固体仍为m克,则反应后滤液中一定含有的溶质是 (填化学式)。
A~F是六种常见的物质,分别由H、O、C、Cl、Ca五种元素中的两种或三种组成,请回答下列问题:
(1)A是一种氧化物,可用作干燥剂,A与C反应能生成E,A的俗称为 。
(2)B、C常温下均为液体,且组成元素相同,B在一定条件下可生成C,B的化学式为 。
(3)对NaOH溶液依次进行实验,现象如图所示:
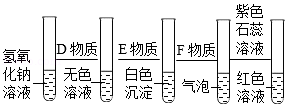
①D和E两种物质分别是 、 (写化学式)。
②加入F的溶液后,沉淀溶解并产生大量气泡,用化学方程式表示产生此现象的原因 。
③最后得到的红色溶液中含有的物质有水、石蕊、 ,下列离子不能与该溶液中的离子共存的是 。
﹣ 2+ 32﹣ 3﹣。
根据下表回答问题:
|
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
|
|
溶解度 /g |
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
|
4Cl |
33.5 |
37.2 |
41.4 |
45.8 |
50.4 |
55.2 |
|
(1)海水中含有大量的氯化钠,海水晒盐的原理是 ,氨碱法制纯碱先向饱和食盐水中通入氨气,通入氨气的作用是 3溶液中加入 以回收氨,使之循环使用。
(2)氯化钠和氯化铵具有相同溶解度的温度范围在 ℃之间。
4Cl溶液,经过如下操作后,得到固体。

I.C中溶液的质量是 4Cl的 (选填“饱和”或“不饱和”)溶液,该溶液中溶质的质量分数为 (结果精确到0.1%)。
II.对以上过程的分析,正确的是 (选填编号)。
①A到B的过程中,溶质质量没有改变
②B中溶质与溶剂的质量比为55.2:100
4Cl固体的温度在40℃至50℃之间。