2017年5月,我国在南海海域成功开采可燃冰。可燃冰外观像冰,主要成份是甲烷水合物(甲烷分子和水分子组成),可表示为 CH4•nH2O,在开采过程中,若甲烷泄漏会导致严重的温室效应。
某化学兴趣小组的同学对甲烷燃烧的产物产生了兴趣,设计实验探究:
[提出问题]甲烷燃烧后生成哪些物质?
[查阅资料]①含碳元素的物质完全燃烧生成CO2,不完全燃烧生成CO;
②白色无水CuSO4粉末遇水变蓝色;
③CO与人体内的血红蛋白结合,会造成人中毒缺氧。
[猜想与假设]猜想一:CO2、H2O. 猜想二:CO、H2O;猜想三:CO2、CO、H2O
[实验探究]将甲烷在一定量的纯净氧气中燃烧的产物依次通过C﹣G装置(部分夹持、固定装置省略)进行验证:
(1)装置A、B中标有数字的仪器名称 ① ,② 。
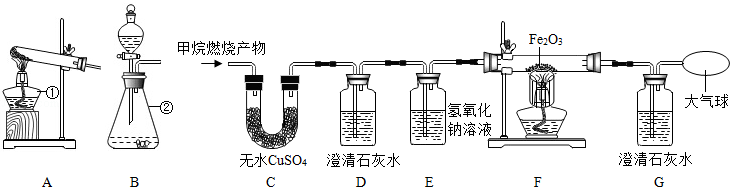
若选用过氧化氢溶液和二氧化锰来制取氧气,应选用的发生装置是 ;该反应的化学方程式为 ;
(2)实验过程中观察到C中白色粉末变为蓝色,D、G中澄清石灰水变浑浊,F中红色粉末变成黑色,由此推断猜想 成立。
(3)实验过程中D装置的作用是 ;该反应的化学方程式是 。
(4)实验过程中用纯净O2而不用空气的原因是 。
(5)实验过程中C、D装置的顺序不能颠倒,原因是 。
[反思与交流]日常生活中,使用含碳燃料一定要注意通风,防止 中毒。
水是人类宝贵的自然资源。
水——生命的源泉
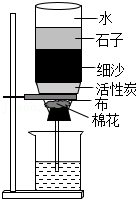
(1)如图为自制简易污水净化装置,该装置中活性炭主要起到 作用。
(2)长期饮用硬水对人体健康不利,生活中常用 方法降低水的硬度。
水——重要的溶剂
(3)生理盐水是溶质质量分数为0.9%的 溶液。现需配制500g生理盐水,请回答下列问题:

①计算:需要称取 的质量是 g。
②配制溶液的操作步骤如上图,正确的操作顺序是 (填字母序号)。
(4)欲从 和 (少量)的混合物中分离出 。根据所给信息,回答下列问题:
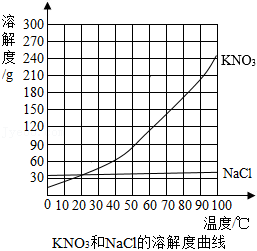
常温下(20℃)溶解度和溶解性的关系
|
溶解度 |
|
|
|
|
|
溶解性 |
易溶 |
可溶 |
微溶 |
难溶 |
①常温下(20℃), 和 的溶解性都属于 。
②80℃时, 的溶解度 (填“大于”、“小于”或“等于”) 的溶解度。
③从该混合物中分离出 的方法是 。
水——化学变化的参与者
(5)水能与生石灰( )反应,这一性质被广泛应用到生产、生活中、请结合所学知识回答下列问题:
①写出水与生石灰反应的化学方程式 。
②列举一条该反应的用途 。
化学促进科技发展,推动社会进步。
(1)中国提出在2030年前实现碳达峰,2060年前实现碳中和,彰显了大国责任与担当。
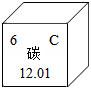
①如图是碳元素在元素周期表中的部分信息。碳元素的质子数是 ,属于 (填“金属”或“非金属”)元素。
②减少 排放,可以减缓 效应。
③自然界中消耗 的主要途径是 。
④为实现碳达峰、碳中和的目标,请写出你的做法 (一条即可)。
(2)2022年6月5日神舟十四号载人飞船成功发射,沈阳航天新光集团有限公司承制生产的连接分离机构再次为发射任务保驾护航。
①载人飞船的制造使用了大量合金,合金的硬度一般比各成分金属 。
②航天员穿着的航天服使用了多种合成纤维,合成纤维属于 (填字母序号)。
| A. |
无机材料 |
| B. |
合成材料 |
| C. |
复合材料 |
2022年我国将有6名航天员生活在空间站。氧气、水、食物等是维持航天员驻留空间站的必要物质。为提高物质的利用率,目前空间站通过以下途径实现物质循环利用:

(1)由图可知,目前空间站通过物质循环获得水的途径共有_____条,其中尿液净化时必须除去尿液中的__________等代谢废物。
(2)为实现氧的循环,目前空间站内利用氢气和航天员呼出的二氧化碳,在一定条件下转化为甲烷和水,化学方程式为
 。据测算,正常情况下一位航天员一天呼出的二氧化碳质量约
千克,若这些二氧化碳全部与氢气反应,则可生成水多少千克?
。据测算,正常情况下一位航天员一天呼出的二氧化碳质量约
千克,若这些二氧化碳全部与氢气反应,则可生成水多少千克?
我国政府承诺在2060年前实现碳中和。为此,控制碳排放和增加碳吸收都至关重要。研究发现,除了陆地植物固碳外,海洋也是重要的固碳之地,如图是海洋吸收二氧化碳的三种方式。
碳酸盐泵:贝壳类、珊瑚等海洋生物将碳元素以碳酸钙的形式沉积起来。某地贝壳堤储存了约 亿吨贝壳,其中 为碳酸钙,则该地贝壳堤固定了多少亿吨碳元素?

开春以来,为提高水稻产量,某农场积极做好科学施肥、精准防治病虫害等工作。
(1)水稻不同生长期需要不同的肥料。如在水稻抽穗、开花时期,为促进穗数增多、籽粒饱满,需要多施磷肥。下列属于磷肥的是_____。
| A. |
碳酸钾( ) |
| B. |
尿素[ ] |
| C. |
磷酸二氢钙[ ] |
(2)氮肥能促进水稻幼苗生长。一百亩水稻需要施碳酸氢铵 千克,用氨气、水和二氧化碳反应来制取,化学方程式为 ,需要氨气多少千克?
(3)井冈霉素是防治水稻纹枯病的常用药。要为一百亩水稻喷洒一次这种农药,需要配制溶质质量分数为 的药液 千克,应购买 的井冈霉素药液_____千克。