氯化钠是一种重要的化工原料。电解氯化钠溶液可制得氯气、氢氧化钠和氢气,反应的化学方程式为2NaCl+2H 2O  Cl 2↑+H 2↑+2NaOH.现取一定质量的氯化钠溶液进行电解,当氯化钠完全反应时,得到85.4g溶液,生成氢气的质量与时间的关系如图所示。请计算:
Cl 2↑+H 2↑+2NaOH.现取一定质量的氯化钠溶液进行电解,当氯化钠完全反应时,得到85.4g溶液,生成氢气的质量与时间的关系如图所示。请计算:
(1)氯化钠完全反应时,生成氢气的质量是 g。
(2)氯化钠完全反应时,生成氢氧化钠的质量是 g。
(3)原氯化钠溶液中溶质的质量分数是多少?

(6分)火箭发射可用联氨(N2H4)做燃料,用四氧化二氮(N2O4)助燃(反应的化学方程式是:2N2H4+N2O4 点 燃 3N2+4H2O),生成物不会对大气造成污染。计算9.6kg的N2H4完全燃烧需要助燃物N2O4的质量。
(4分) 味精的主要成分为谷氨酸钠(化学式为C5H8NO4Na),因能增加食品的鲜味,促进食欲而成为家庭常用的调味品。请回答
⑴谷氨酸钠由 种元素组成。
⑵谷氨酸钠中碳、氢元素的质量比为 。
(10分)小强买来一包黄铜(铜、锌合金),包装说明如右图,他对包装说明上的质量分数产生了疑问,他称取20g黄铜样品放入烧杯中,然后往烧杯中加入稀硫酸93.7g,恰好完全反应,反应后称得烧杯内物质共113.5g。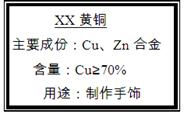
(1)反应产生氢气g。
(2)通过计算判断该黄铜样品中铜的质量分数是否与包装说明相符(计算结果精确到0.1%,下同)。
(3)计算反应后所得溶液中溶质的质量分数是多少?
(6分)为防止玉树地震灾区的病菌传播,防疫人员使用了“漂白粉”来杀菌消毒, “漂白粉”的有效成分为次氯酸钙[化学式为:Ca(ClO)2]。请回答:
(1)钙、氯、氧三种元素的原子个数比为。
(2)钙、氯、氧三种元素的质量比为。
(3)次氯酸钙中氯元素的质量分数是(精确到0.1%)。
(4)若灾区饮用水每50kg至少需要漂白粉250g,则消毒一桶水(约20kg)至少须加漂白粉g。
(10分)石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4 g石灰石样品,把20 g稀盐酸分4次加人样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:
| 稀盐酸的用量 |
第一次加入5 g |
第二次加入5 g |
第三次加入5 g |
第四次加人5 g |
| 剩余固体的质量 |
3 g |
2 g |
l g |
1 g |
求:(1)该石灰石样品中碳酸钙的质量是多少?
(2)该反应中共生成二氧化碳多少克?