实验课上,同学们利用下列装置进行气体制备的学习。请回答下列问题:

(1)编号①的仪器名称是 。
(2)用加热法制取氧气,所选择的发生装置是 (填字母,下同),收集装置是 ,反应的化学方程式为 。
(3)若要制取瓶纯净、干燥的二氧化碳气体 (常混有少量氯化氢气体和水蒸气,装置连接的正确顺序是:产生气体→ → →F.检验二氧化碳气体的方法是 。
在某次探究活动中,小明同学往NaHCO 3溶液中加入NaOH溶液,未观察到明显现象,即认为两者没有发生化学反应,小亮同学却有疑问。
【提出问题】在溶液中,NaHCO 3和NaOH真的不反应吗
【猜想假设】
(1)溶液中,NaHCO 3和NaOH要反应
(2) ;
【查阅资料】(1)可溶于水的酸、碱、盐在水中能解离出对应的阳离子和阴离子。
(2)部分碱、盐的溶解性表(室温)
|
阴离子 阳离子 |
OH ﹣ |
Cl ﹣ |
CO 3 2 ﹣ |
HCO 3 ﹣ |
|
Na + |
溶 |
溶 |
溶 |
溶 |
|
Ba 2+ |
溶 |
溶 |
不 |
溶 |
【进行实验】
|
实验序号 |
实验操作 |
实验现象 |
|
1 |
往NaHCO 3溶液中加入BaCl 2溶液 |
无明显现象 |
|
2 |
往NaHCO 3溶液中加入NaOH溶液 |
无明显现象 |
|
3 |
将实验1和实验2所得的溶液混合 |
有沉淀生成 |
【解释与结论】
(1)根据实验1中无明显现象,可得到的结论是 (选填字母编号)
A.混合溶液中没有NaCl B.混合溶液中没有Ba(HCO 3) 2;
C.混合溶液中没有NaHCO 3 D.混合溶液中的阴、阳离子不能形成不溶物
(2)实验3中生成的沉淀为 (填化学式),该沉淀中的阴离子只能来源于实验 (选填"1"或"2")所得到的溶液,则实验 (选填"1"或"2")必定发生了化学反应,写出该反应的化学方程式 。
(3)依据上述实验及分析,猜想 成立。
【总结反思】两种溶液混合,未能观察到明显现象而化学反应 (选填字母编号)
A.一定没发生 B.一定发生了 C.不一定没发生
某实验小组在做“用澄清石灰水检验二氧化碳”的实验时,发现一个有趣的实验现象:
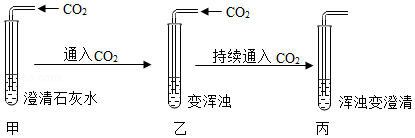
试管中浑浊现象为何消失?实验小组的同学对此实验进行了下列探究活动:
(1)根据已学知识,实验小组对CO2使澄清石灰水变浑浊的现象作出了合理的解释,其化学方程式为 。
(2)【查阅资料】
①碳酸盐一般不溶于水,如碳酸钙不溶于水。
②碳酸钙能与二氧化碳、水反应生成碳酸氢钙[Ca(HCO3)2],碳酸氢钙易溶于水。
③碳酸氢钙受热易分解,生成碳酸钙、二氧化碳、水。
从物质组成角度分类,碳酸氢钙应属于 。
A.氧化物 B.酸 C.碱 D.盐
写出碳酸氢钙受热分解的化学方程式 。
【提出问题】碳酸氢钙能与哪些物质反应呢?
【假设与猜想】猜想I:能与盐酸反应
猜想∐:能与氢氧化钠反应
……………
(3)【设计实验并验证】
|
实验步骤 |
实验现象 |
结论 |
|
实验一:取丙中少量液体于试管中,滴加稀盐酸 |
有 生成 |
猜想I成立 |
|
实验二:取丙中少量液体于试管中,滴加氢氧化钠溶液 |
有白色沉淀生成 |
猜想II成立 |
|
实验三:取丙中少量液体于试管中,加热 |
澄清液体又变浑浊 |
验证了资料描述 |
根据验证实验写出碳酸氢钙与盐酸反应的化学方程式 。
【讨论与反思】
该实验小组在实验中发现问题,并对问题进行不断探究。他们不但发现了新的物质,还了解了它的一些性质,并对生活中煮沸可以降低水的硬度、水垢的形成以及自然界中溶洞与钟乳石的形成有了更进一步的认识。
如图是实验室制取与收集气体的装置图,据此回答有关问题。
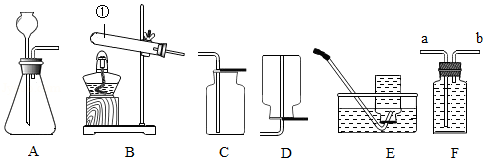
(1)仪器①的名称是 。
(2)实验室用石灰石与稀盐酸制取二氧化碳气体,应选用的发生装置和收集装置的组合是(填序号) ,反应的化学方程式为 ;该组合装置还可以用来制取氧气,其化学方程式为 。
(3)实验室利用F装置收集氢气时,气体应从 端(填“a”或“b)通入。
草酸存在于自然界的植物中。草酸晶体(H 2C 2O 4•2H 2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。草酸能与氢氧化钙反应生成沉淀:H 2C 2O 4+Ca(OH) 2=CaC 2O 4↓+2H 2O.请回答下列问题:
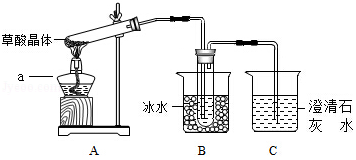
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,仪器a的名称是 。装置B的主要作用是 。装置C中有气泡逸出,澄清石灰水变浑浊,由此可知草酸晶体分解的产物中一定有 。
(2)乙组同学认为草酸晶体分解的产物中还有CO,为进行验证,选用甲组实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。

①乙组同学的实验装置依次连接的合理顺序为:A→B→( )←( )→( )→I→D→H。
②装置I中盛有的氧化铁发生了颜色变化,欲证明草酸晶体分解的产物中有CO,乙组同学需要两次使用装置D,其现象分别是 。
无论在化学世界里,还是在日常生活中,酸是广泛存在而又非常重要的物质。下面对常见的酸﹣硫酸的部分性质进行探究。

(1)浓硫酸的特性
①向一个烧杯中加入一定质量的浓硫酸,总质量为m 1;敞口放置在空气中一段时间后,总质量为m 2,那么m 1 m 2(选填(选填">、"="、"<")。
②如图2所示,将水滴入装有浓硫酸的锥形瓶中(锥形瓶和木板用熔化的石蜡粘在一起),观察到液滴四溅。据此图2分析,下列关于浓硫酸的叙述正确的是
A.稀释浓硫酸时,一定要将浓硫酸缓慢注入水中
B.稀释浓硫酸时,一定要将水缓慢注入浓硫酸中
C.浓硫酸充分溶于水后,可以将锥形瓶从木板上轻轻提高
(2)与金属反应
向装有镁、铁,铜的A、B、C三只试管中(如图2),分别加入等质量等质量分数的稀硫酸,不能观察到明显现象的是 (填序号);请写出反应最剧烈的试管中发生反应的化学方程式 。
(3)与非金属反应
将冷的浓硫酸加入到装有碳粉的圆底烧瓶中,无明显现象:加热该混合物、有大量气泡产生,现对导出的气体成分进行验证。
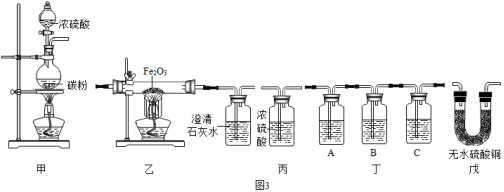
【查阅资料】
①碳与浓硫酸在加热时,除了生成水之外,还生成二氧化硫和碳的一种氧化物;
②二氧化硫和二氧化碳都能使澄清石灰水变浑浊,其中,二氧化硫还能使紫红色的酸性高锰酸钾溶液褪色。
【实验验证】某化学兴趣小组在老师指导下设计了如图3实验装置进行验证。
温馨提示:丁装置的A、B、C中均装有紫红色的酸性高锰酸钾溶液
①为了完成对导出气体的验证,请将上述装置进行正确的连接:
甲→ → →丙 (填序号,此小题2分)
②请完成如表中的相关内容:
|
实验现象 |
实验结论 |
|
乙中观察到的现象 |
证明碳与浓硫酸加热反应生成碳的氧化物是二氧化碳而不是一氧化碳 |
|
丁装置A中溶液褪色 丁装置C中溶液不褪色 |
证明气体中有 装置C的作用 |
|
戊中白色固体变蓝 |
证明气体中有水蒸气 |
【获得结论】碳与浓硫酸加热反应的化学方程式 。