某化学兴趣小组的同学,通过咨询老师准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的SO2 (Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O)。老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质。兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
【提出问题】①该瓶溶液中溶质的成分是什么?
②该瓶溶液中亚硫酸钠的质量分数是多少?
【查阅资料】
(1)Na2SO3有较强还原性,在空气中易被氧气氧化:2Na2SO3+O2═2Na2SO4;
(2)Na2SO3能与酸反应产生SO2气体;
(3)SO32﹣、SO42﹣均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
【作出猜想】
猜想1:没有变质,成分是Na2SO3;
猜想2:完全变质,成分是Na2SO4;
你认为还可能有的猜想3 。
【实验探究Ⅰ】甲、乙两组分别进行实验探究溶液是否变质:
小组 |
实验操作 |
现象 |
结论 |
甲组 |
取少量样品于试管中加入过量稀盐酸; |
产生气泡 |
没有变质,还是Na2SO3 |
乙组 |
取少量样品于试管中加入氯化钡溶液,再加入足量稀盐酸。 |
|
已部分变质 |
【评价】有同学质疑甲组方案不合理,理由是 。
【实验探究Ⅱ】
甲组设计如下实验测定Na2SO3溶液的溶质质量分数。(注:空气中二氧化碳的影响忽略不计)
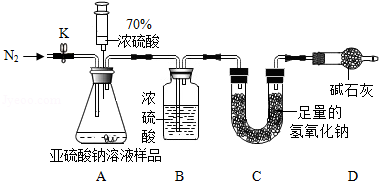
(1)连好装置并检查装置气密性,在锥形瓶中放入126g该样品;
(2)实验前称量C装置的质量;
(3)关闭活塞K,用注射器推入浓硫酸至不再产生气泡;
(4)打开活塞K,缓缓鼓入一定量的氮气,关闭活塞K;
(5)再次称量C装置的质量发现比反应前增重6.4g
由此,计算出该溶液中Na2SO3的质量分数为 ;
【解释】若没有进行第4步操作,则测得亚硫酸钠溶液的溶质质量分数比实际的 (填“偏小”或“偏大”)。
乙组仍使用第一次实验的原理,进行如下实验测定Na2SO3溶液的溶质质量分数。
第一步:称取试样ag;
第二步:在溶液中加入过量氯化钡溶液和足量稀盐酸;
第三步:过滤、洗涤、烘干沉淀;
第四步:称量沉淀的质量为bg;
第五步:计算溶液中Na2SO3的溶质质量分数。
试完成下列问题:
(1)加入氯化钡溶液过量的目的是 。
(2)第三步操作要洗涤沉淀的原因是 。
【反思】由此可得出,保存亚硫酸钠时应 。
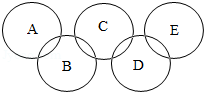
第31届夏季奥林匹克奥运会于今年8月5日至21日在巴西举行,奥运五环旗将在南美洲上空飘扬,现有A﹣E分别为盐酸、硫酸钠溶液、碳酸钠溶液、氯化钡溶液、氧化铜的五种常见物质,存在类似“奥运五环”的如图图示反应关系.已知常温下相连环的物质间能发生反应,不相连环的物质间不能发生反应,其中B常用于除铁锈.
请回答下列问题:
(1)写出化学式:A ,D .
(2)A+B反应的化学方程式为 .
(3)C+D反应的化学方程式为 .
铝、铁、铜是人类广泛使用的三种金属,与我们的生活息息相关,
(1)用铜块制成铜片、铜丝利用了铜的 性。钢铁制品容易发生锈蚀,在其表面涂油漆的防锈原理是 。
(2)把两块大小相同且洁净的铁片、铜片分别投入浓度相同的稀硫酸中,请描述你观察到的现象并分析其中的原因。
(3)将纯铝和铝合金相互刻划,纯铝上留下明显划痕。请你解释其中的原因。
(4)自行车用到大量铝合金材料,外形美观,材质轻硬、牢固,除了代步,还可以作为健身工具。由此你对化学与人类生活的关系有何感想(任写一点)?
结合下列实验装置,回答:
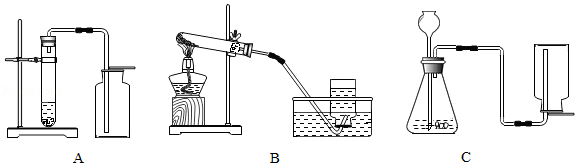
(1)实验室若用分解暗紫色固体制取O2,该固体的名称是 ,可选 (填字母,下同)装置。若用分解H2O2溶液制取O2,可选 装置。
(2)探究CO2性质的装置Ⅰ、Ⅱ如下:

①装装置Ⅰ,将Y形导管平放于桌面上,通入CO2后,观察到a管中试纸变红色,
b管中试纸无明显变化,此现象说明CO2能与 反应,生成的 使紫色石蕊变红色。
②装置Ⅱ,将Y形导管固定在铁架台上,a管在上方,b管在下方,通入CO2后,观察到b管中试纸先变红色且颜色较深,a管中试纸后变红色且颜色较浅,此现象说明CO2具有①所验证的性质外,还说明CO2的 。
(3)实验室制取CO2的化学方程式为 ,应选 (填字母)装置,选择该装置的理由是 。
规范操作是实验成功的前提。回答:
(1)实验用剩的药品 (填“要”或“不要”)放回原瓶, (填“能”或“不能”)拿出实验室。
(2)右图①、②操作中,正确的是 (填序号)。
(3)不规范的操作会引起意外。在以下列举的四种意外中选择回答:
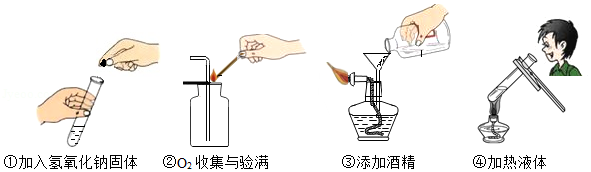
A.液体溅出伤人B.着火引起意外
C.酒精溢出致火焰熄灭D.试管骤冷破裂
操作③可能引起 (填字母,下同);
操作④可能引起 。
氯化钙在生活中常用作干燥剂、融雪剂。下图是某探究小组用含有MgCO3、MgSO4、Al2O3杂质的石灰石样品制取氯化钙的流程(所加入的试剂均为适量)。回答:

(1)氯化钙中钙元素的化合价为 。
(2)①中共发生了 个化学反应。
(3)②中除去的杂质离子是 。
(4)③中一个反应的化学方程式为 。
(5)滤渣的成分有氢氧化镁、 和 。