向20g铜锌合金中不断加入一定溶质质量分数的稀盐酸,加入稀盐酸的质量与固体质量的关系如图所示。请计算:
(l)合金中锌的质量分数为 。
(2)所用稀盐酸的溶质质量分数。(计算结果保留一位小数)

A~J是初中化学常见的物质,它们的相互转化关系如图所示。其中A是一种常见的化肥,不能与碱性物质混合使用;H和D的组成元素相同;I是一种红棕色固体。

请回答下列问题:
(1)反应①的基本反应类型为 ;
(2)B的化学式为 ,D的化学式为 ;
(3)反应④的化学方程式为 ,其实际应用为 。
化学是研究物质的组成、性质以及变化规律的科学.化学学习过程要关注物质的性质以及发生哪些变化和发生变化过程中的现象.现有A、B、C三种物质,它们可能是O2、Fe、H2O、H2O2、CaO、Fe2O3、HCl、NaOH、Ca(OH)2、Na2CO3中的一种.
(1)若A、B是由相同元素组成的化合物,且B分解能产生A和C.请写出该化学反应方程式 .
(2)若A、B中含有相同的金属元素,并均可与C的溶液反应,生成金属元素化合价不同的两种盐溶液.则C的化学式是 ;请写出能产生黄色溶液的化学反应方程式 .
(3)若A、B、C是三种不同类别的物质,分别属于酸、碱和盐,将它们依次加入同一个烧杯中.
①若均无明显现象,则A、B、C分别是 (填化学式).
②若能产生白色沉淀,请写出酸、碱中和的化学反应方程式 .
金属材料在 生产、生活中有着广泛的应用,人类的生产和生活都离不开金属。

(1)新型材料纳米级铁粉具有广泛的用途,它比普通铁粉更易与氧气反应,其制备的主要流程如图1所示。
①高温反应器中反应的化学方程式为 。
②反应前需向反应器中通入氮气,目的是 。
(2)金属活动性顺序有重要的应用,铝、铜、铁为日常生活中常见的金属,某化学小组的同学在探究铝、铜、铁三种金属的有关性质时,进行了如图2的实验:
①在A实验中发生反应的化学方程式为 。
②将A实验结束后①、②试管内的物质倒入烧杯中,发现烧杯中的红色固体物质明显增多,其原因是 ,一段时间后过滤,滤液中的溶质一定有 (填化学式)。
(3)某同学在一定质量的AgNO3和Cu(NO3)2的混合溶液中加入铁粉,充分反应后,他对反应过程进行了分析,得到了如图3的几个图象(横坐标表示加入铁的质量),其中错误的是 (填字母序号)。
为测定某种贝壳中碳酸钙的含量,取25g贝壳,逐渐加入稀盐酸,充分反应后,测得剩余固体质量与加入稀盐酸的质量关系如图所示(已知杂质不参与反应,也不溶于水)请计算:
(1)这种贝壳中碳酸钙的质量分数是 。
(2)25g贝壳与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数。

镁被誉为“国防金属”,工业上通常用海水制取金属镁,有以下两个方案:
方案一:
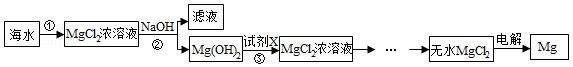
方案二:
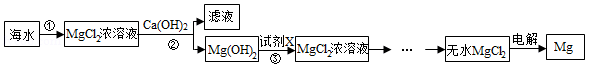
请回答下列问题:
(1)每吨试剂价格表:
|
试剂 |
NaOH |
Ca(OH)2 |
|
价格(元/t) |
3200 |
1200 |
工业生产为了获得更高的利润,根据上表分析,最好选择方案 (填“一”或“二”).
(2)步骤②中加入试剂充分反应后的操作是 ;
(3)步骤③发生反应的化学方程式 ;
(4)在MgCl2 Mg+Cl2↑反应中化合价发生变化的元素有 种.
Mg+Cl2↑反应中化合价发生变化的元素有 种.