如图为实验室常见的气体制备、收集和性质的实验装置,据图回答。
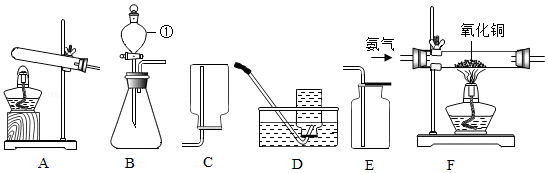
(1)指出B装置中标号仪器名称:① 。
(2)实验室用大理石与稀盐酸反应制取CO2应选择的发生装置是 (填装置序号,下同),收集装置是 ,反应的化学方程式是 。
(3)实验室用加热氯化铵和氢氧化钙固体混合物制取氨气,应选择的发生装置是 。为探究氨气的性质,小红利用图中F装置进行氨气与氧化铜反应的实验,实验中观察到黑色氧化铜粉末变成红色。
【提出问题】得到的红色粉末是什么?
查阅资料:Cu2O是红色,易与稀硫酸反应:Cu2O+H2SO4=CuSO4+Cu+H2O
【猜想假设】红色粉末是①Cu②Cu2O③
【设计实验】小明设计如下实验验证红色粉末中是否含有Cu2O:
实验步骤 |
实验现象 |
实验结论 |
取红色粉未于试管中,加入足量稀硫酸 |
|
红色粉末中含有Cu2O |
【实验反思】小明设计的实验无法证明红色粉末中是否含有Cu,原因是 。
在“氮气、氢气、石墨、石油、活性炭、钛合金”中选择适当的物质填空:
(1)未来最理想的清洁能源是;
(2)具有优良导电性的非金属单质是;
(3)为延长灯泡的使用寿命常充入的气体是;
(4)用于制糖工业中的脱色剂是;
(5)医疗上用来制造人造骨的是;
(6)被称作“工业的血液”的是。
如图是实验室制取气体的常用装置。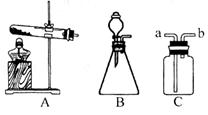
(1)A中的试管口为什么应略向下倾斜?
(2)写出选用B制取氧气的化学方程式。
(3)若采用C (气体由a口进入)收集到一种气体,请简述验证该气体的实验方法。
请用化学方程式表示下列反应的原理。
(1)天然气(主要成分是CH4)用作燃料。
(2)常温下,铝具有很好的抗腐蚀性能,是因为铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜。
(3)二氧化碳使澄清石灰水变浑浊。
明矾可用于净水,是因为明矾溶于水生成的胶状物可以悬浮于水中的杂质,
使水澄清,除去硬水中过多的Ca2+和Mg2+就可得到软水;通常可用来检验硬水与软水;日常生活中常用的方法来降低水的硬度。
王佛松院士在《展望21世纪的化学》一书中提出一个极为重要的观点:“任何物质和能量以至于生物,对于人类来说都有两面性。即任何物质都对人类有益,同时也对人类有害”。
我能选择一种物质说明它的两面性。我选取的物质是
它对人类有益的一面是
它对人类有害的一面是