氢气作为新能源有很多优点,制取与储存氢气是氢能源利用领域的研究热点。
I.制氢:铁酸锌(ZnFe 2O 4)可用于循环分解水制氢,其反应可表示为:
6ZnFe 2O 4  6ZnO+4Fe 3O 4+O 2↑;3ZnO+2Fe 3O 4+H 2O
6ZnO+4Fe 3O 4+O 2↑;3ZnO+2Fe 3O 4+H 2O  3ZnFe 2O 4+H 2↑
3ZnFe 2O 4+H 2↑
(1)ZnFe 2O 4中Fe的化合价为 。
(2)该循环制氢中不断消耗的物质是 (填化学式),得到H 2和O 2的质量比为 。
(3)氢气作为新能源的优点有 (任写一点)。该循环法制氢的不足之处是 。
Ⅱ.贮氢:合金Mg 2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学方程式为:2Mg 2Cu+3H 2  3MgH 2+MgCu 2
3MgH 2+MgCu 2
(4)熔炼制备Mg 2Cu合金时,通入氩气的目的是 。
(5)氢化物MgH 2与水反应生成一种碱,并释放出H 2. 其化学反应方程式为 。
(6)11.2g Mg 2Cu完全吸氢后所得混合物与过量盐酸反应,放出H 2的质量为 g。
小明按如图所示进行趣味实验,将U形管开口端放入烧杯内,观察到溶液进入U形管并流入另一端。

(1)烧杯内的溶液呈_____色。
(2)二氧化碳与氢氧化钠溶液反应的化学方程式为_____。
(3)U型管开口端放入烧杯后,管内气体压强_____(选填“增大”“不变”或“减小”),溶液在管内上升并流入另一端。
为了参加2023年5月举行的化学实验操作考试,各学校积极组织了实验操作训练。小姚同学完成了“稀盐酸、氢氧化钠溶液、蒸馏水的鉴别”实验,请你帮他完成实验报告的填写。
【实验题目】稀盐酸、氢氧化钠溶液、蒸馏水的鉴别
【实验目的】选择合适的指示剂鉴别稀盐酸、氢氧化钠溶液、蒸馏水
【实验仪器】小试管5支、试管刷等
【实验药品】随机编号为A、B、C的三种待测液,酚酞试液(装于滴瓶),石蕊试液(装于滴瓶)
【实验过程】
(1)
|
实验步骤 |
实验现象 |
实验结论 |
|
①分别取A、B、C待测液 于三支试管中,分别滴入 滴石蕊试液,振荡。 |
B中的石蕊试液变_____,另外两支试管中的液体呈蓝色、紫色,但颜色相近。 |
鉴别出B是_____,A、C无法准确鉴别。 |
|
②另取A、C待测液 于两支试管中,分别滴入 滴酚酞试液,振荡。 |
C中的酚酞试液变_____,A中无明显现象 |
鉴别出C是_____,A是蒸馏水。 |
【交流反思】
(2)小峰同学认为,只用酚酞试液也能完成该实验,他设计方案并完成了实验。
|
实验步骤 |
实验现象 |
实验结论 |
|
①分别取A、B、C待测液 于三支试管中,分别滴入 滴酚酞试液,振荡。 |
C中液体呈红色,A、B中无明显现象 |
鉴别出C |
|
②将①中的红色液体分为两等份,_____。 |
观察到其中一支试管有明显的现象:_____。 |
发生反应的化学方程式为_____,鉴别出A、B. |
气体的制取和性质是初中化学核心知识之一,结合以下实验装置图回答问题。
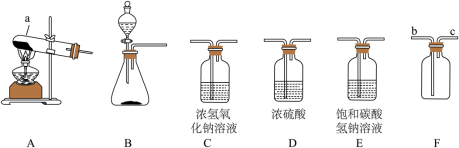
(1)仪器a的名称是_____。
(2)实验室制取二氧化碳的化学方程式是_____,你选择的发生装置是_____(填字母编号)。
(3)检验二氧化碳可选用_____(填数字编号)。
①氢氧化钠溶液
②氯化钙溶液
③氢氧化钙溶液
④蒸馏水
(4)实验室若要收集一瓶纯净、干燥的二氧化碳气体,装置的正确连接顺序是B→_____→_____→F,验满的方法是_____。
(5)同学们在体育考试中,做引体向上时,将“镁粉”抹在手掌上以增大摩擦力。“镁粉”到底是什么物质呢?与老师交流后,了解到“镁粉”【化学式可表示为 】是一种受热易分解的白色固体,分解产物全部是氧化物。为了确定“镁粉”的化学式,同学们设计了实验方案并进行了定量探究:
①依次连接装置A→D→C,并检查其气密性。
②在A装置中加入 “镁粉”,加热,充分反应后测得D装置增重 ,C装置增重 (产生的气体完全被吸收,不考虑空气对测定结果的影响)。同学们通过分析计算,最终确定“镁粉”的化学式为_____。
某小组采用图a所示实验装置探究 还原 时,出现了争论。甲同学观察到固体由红色变成黑色,推断黑色固体是 ;乙同学提出质疑,认为黑色固体可能是 ,并查阅了资料: 可被磁铁吸引,几乎不溶于稀的酸溶液。

(1)制备
的原理是: (
在常温下为液态),图b所示三种气体发生装置中,可用于制备
的是______(填标号)。
(
在常温下为液态),图b所示三种气体发生装置中,可用于制备
的是______(填标号)。
(2)若甲同学推断正确,反应的化学方程式为______。
(3)对乙同学提出的质疑进行分析和验证。
①定量分析物质组成可知,该反应生成 是合理的,理由是______。
②该小组通过对黑色固体进行检验,证明同时含有 和 .检验的操作和现象是:取样于试管中,______。
(4)该小组为了探索 还原 与温度的关系,走访了某钢铁厂。工程师用SDTQ热分析仪对该反应进行研究,根据不同温度下所得固体的质量,推导对应的固体成分,结果如图。

①用 炼铁时,还原 的温度应不低于______ 。(填“ ”“ ”或“ ”)
②图中: ______。
③该小组查阅资料得知酒精灯加热温度为
左右,他们发现上述对黑色固体成分的检验结果与图像有矛盾,推测黑色固体在冷却过程中发生了以下反应:______ ______。
______。
制盐在我国有着悠久的历史。某盐湖水样品含有 及少量 和 ,某小组从中获取 和 的主要过程如下:

(1)“除杂1”应依次加入的两种试剂是______、______,“除杂2”应加入的试剂是______。(除杂限选试剂: )
(2)将“溶液A”在 蒸发浓缩,至有少量固体析出。

①该小组分析溶解度曲线,推测析出的少量固体是 ,但检验后却发现是 。请作出合理解释:______。
②该小组停止蒸发浓缩,经______、过滤得到大量 固体及母液;将母液中的 分离出来,操作是______。
(3)设计由硫磺(单质硫)生产 的转化路径,依次写出反应的化学方程式:______。(提示:常见 价硫的化合物可与 化合为 价硫的化合物)