科学探究和证据推理是化学学科的核心素养。学习小组对蓝绿色碱式碳酸铜晶体[Cu2(OH)2CO3]的性质进行实验探究,并基于证据进行推理分析。
I.分析碱式碳酸铜的组成
根据化学式可知,碱式碳酸铜中Cu元素的化合价为 。
Ⅱ.探究碱式碳酸铜受热的变化
[设计实验]学习小组设计了如图装置(夹持仪器已略去),并用于探究碱式碳酸铜的分解产物。
[实验过程]
①在装置丙导管a处连接一导管,并插入水中,微热试管,观察到 ,说明整套装置的气密性良好。
②按图示加入样品和试剂,加热一段时间后,试管中固体变黑,U形管中无水硫酸铜变蓝,澄清石灰水变浑浊。
[实验分析]

①装置甲中用于加热的仪器名称为 。
②装置丙中发生反应的化学方程式为 。
③根据现象可知,碱式碳酸铜受热可分解,分解产物有CO2、CuO、 。
④装置乙、丙位置不能互换的理由是 。
Ⅲ.探究碱式碳酸铜与酸的作用
[实验过程]取样品少量于试管中,加水,固体不溶解。继续加入足量稀硫酸,有气泡产生,得到蓝色溶液。
[实验结论]碱式碳酸铜能与硫酸发生反应,生成的盐为 。
[拓展延伸]碱式盐在生活中应用广泛。碱式氯化铝[Al2 (OH)Cl5]是一种高效净水剂。写出碱式氯化铝与盐酸发生反应的化学方程式 。
已知Mg能在CO 2中燃烧生成碳和一种白色固体物质,某化学兴趣小组用如图所示装置制备CO 2并对Mg在CO 2中燃烧生成的白色固体物质进行探究.
实验过程:连接好装置并检查装置的气密性,装入药品,打开活塞,让A中产生的气体依次通过B,C,待气体充满集气瓶后,用坩埚钳夹住8﹣10cm长的用砂纸打磨干净的镁条,将镁条点燃后迅速插入到正不断通入CO 2的集气瓶中,待剧烈反应平息后,关闭活塞,即可看到集气瓶内壁和底部有白色固体和黑色物质出现.
查阅资料:①饱和NaHCO 3溶液可以吸收HCl而不吸收CO 2;②MgO、Mg(OH) 2、MgCO 3均为白色固体.
(1)仪器a的名称是 .
(2)装置B中发生反应的化学方程式是 ,装置C的作用是
(3)检验D中集气瓶已经充满CO 2的方法是
(4)白色固体物质是什么?甲同学提出了三种猜想:
猜想Ⅰ:白色固体物质是MgO
猜想Ⅱ:白色固体物质是Mg(OH) 2
猜想Ⅲ:白色固体物质是MgCO 3
①上述猜想中,你认为不合理的猜想是 (填Ⅰ或Ⅱ或Ⅲ),理由是 .
②乙同学取D中的白色固体于试管中,向其中加入足量的稀硫酸,固体溶解,无气泡产生,据此可知猜想 (填Ⅰ或Ⅱ或Ⅲ)是合理的,则镁在D中发出反应的化学方程式是 .

天然水净化为自来水的主要流程如下:

(1)下列说法不正确的是(填字母) .
A.过滤池可以除去难溶性杂质
B.活性炭吸附池可以除去水中的色素和臭味
C.清水池中一定是软水
(2)明矾[KAl(SO 4) m•12H 2O]能作絮凝剂,是因为明矾溶于水后生成具有吸附作用的胶状物氢氧化铝.m= ,氢氧化铝的化学式为 .
(3)目前不少自来水用液氯(Cl 2)作为消毒剂,液氯注入水后发生反应的示意图:

其中"  "、"○"、"●"代表不同原子,产物D为次氯酸(HClO),有杀菌消毒作用.
"、"○"、"●"代表不同原子,产物D为次氯酸(HClO),有杀菌消毒作用.
①C物质的水溶液能使紫色的石蕊溶液变成 色,取C物质的水溶液少许,向其中加入稀硝酸和硝酸银溶液,观察到有白色沉淀产生,发生反应的化学方程式是 ,利用此法可检验自来水中是否含有Cl ﹣.
②液氯与水反应的化学方程式是 .
(4)天然水中微生物使有机物(以C 6H 10O 5表示)转化为CO 2和H 2O的过程中所需O 2的量叫做生化需氧量(BOD,单位为mg•L ﹣ 1),反应的化学方程式为:C 6H 10O 5+6O 2  6CO 2+5H 2O,测得20℃时1L某天然水样中含有机物(C 6H 20O 5)的质量为10.8mg,则该水样的BOD值是多少?(写出计算过程)
6CO 2+5H 2O,测得20℃时1L某天然水样中含有机物(C 6H 20O 5)的质量为10.8mg,则该水样的BOD值是多少?(写出计算过程)
掌握科学的研究方法,探索化学世界的奥秘.
(1)分类是学习化学的重要方法之一.
①生活中,常会接触到下列物质:
A.铜丝 B.甲烷 C.过氧化氢 D.碘酒
其中属于混合物的是(填字母,下同) ,属于氧化物的是 .
②根据物质在转化过程中的特点,可将化学反应分为化合反应,分解反应、置换反应和复分解反应四种基本反应类型,下列转化不属于这四种基本反应类型的是 .
A.生石灰与水反应 B.一氧化碳还原氧化铁 C.中和反应
(2)实验是学习化学的一条重要途径,实验室中可用KClO 3在MnO 2催化下受热分解制取氧气,并将反应后的混合物进行分离回收,实验操作如图所示(MnO 2难溶于水)
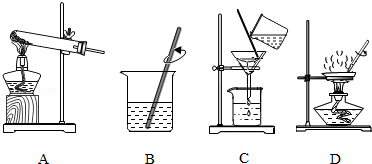
①图A中试管口略向下倾斜的原因是 ,图B操作中玻璃棒的作用是 .
②图C操作中的一处明显错误是 ,图D操作中,当看到 ,停止加热.
(3)质量守恒定律是帮助我们学习的认识化学反应实质的重要理论.
①下列表述正确的是
A.蜡烛燃烧后质量减小,说明质量守恒定律不是普遍规律
B.每32g S和32g O 2完全反应后,生成64g SO 2
C.在化学反应aA+bB=cC+dD中一定有:a+b=c+d
②有机化合物R与足量氧气置于密闭容器中充分反应生成CO 2和H 2O,实验测得反应前后物质的质量如下表:
|
R |
O 2 |
CO 2 |
H 2O |
|
|
反应前质量/g |
46 |
128 |
0 |
0 |
|
反应后质量/g |
0 |
32 |
x |
54 |
则x= ,已知参加反应的物质R与氧气的分子个数之比为1:3,则R的相对分子质量是 .
化学使人类生活更美好.
(1)豆浆已成为众多家庭的饮品,下表是豆浆中部分营养成分的平均质量分数.请据表回答:
|
成分 |
蛋白质 |
油脂 |
糖类 |
钙 |
铁 |
维生素 |
|
质量分数/% |
1.8 |
0.7 |
1.1 |
0.01 |
0.0005 |
0.015 |
①豆浆中含有人体所需的微量元素是 ,青少年因缺 而导致佝偻病.
②豆浆所含的营养素中不能供给人体能量,但可以起到调节新陈代谢作用的是 (填字母,下同)
A.蛋白质 B.油脂 C.糖类 D.维生素
(2)材料对我们的生活影响越来越大.
①用作保险丝的武德合金属于
A.金属材料 B.合成材料 C.复合材料
②下列方法不能防止钢铁腐蚀的是
A.表面镀铬 B.表面涂油漆 C.部分浸入食盐水
③有一种用"冰蚕丝"面料做的衣服,面料的主要成分是合成纤维,鉴别"冰蚕丝"和天然蚕丝的化学方法是 .
我国拥有地球上7%的耕地,但化肥使用量却占全球总量的35%,认识化肥,科学施肥至关重要。
(1)下列物质中,可用作磷肥的是 :
A.K 2SO 4 B.CO(NH 2) 2 C.KNO 3 D.Ca(H 2PO 4) 2
(2)NH 4Cl是常见的氮肥,不能与碱性物质混用,否则会因释放出 而损失肥效;
(3)过度使用化肥造成的后果有:① ;②水体富营养化等;
(4)"雷雨发庄稼"现象涉及的化学反应较为复杂,其中一个反应是NO 2与H 2O反应生成HNO 3和NO,写出该反应的化学方程式: ;该反应中。化合价发生改变的元素是_ (填元素符号)。