某工厂产生的烧渣(主要含FeO、Fe 2O 3,还有一定量的SiO 2)可用于制备七水合硫酸亚铁晶体(FeSO 4•7H 2O),其工艺流程如下:
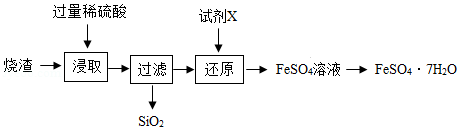
查阅资料:SiO 2不溶于水,也不与稀硫酸反应。
(1)"浸取"步骤中,FeO、Fe 2O 3和稀硫酸发生反应的化学方程式分别为
FeO+H 2SO 4=FeSO 4+H 2O、 。
(2)为提高"浸取"步骤的反应速率,可采取的具体措施有 (写2条,不考虑"搅拌"和"使用催化剂")。
(3)"还原"步骤的目的是将Fe 3+转化为Fe 2+,试剂X可用SO 2或Fe。
①若试剂X是SO 2,转化原理为SO 2+Fe 2(SO 4) 3+2Y═2FeSO 4+2H 2SO 4,则Y的化学式是 。
②若试剂X是Fe,转化原理为Fe+Fe 2(SO 4) 3=3FeSO 4.测得"还原"后溶液的pH明显增大,其原因是 。
中和反应是化学核心概念之一。某化学兴趣小组对中和反应展开了探究。
[实验目的]证明氢氧化钠溶液与盐酸发生化学反应。
[实验步骤]
步骤一:取一定量稀氢氧化钠溶液于烧杯中,滴加2滴酚酞试液,溶液呈红色。
步骤二:用仪器A吸取稀盐酸向烧杯中逐滴加入,边滴加边用玻璃棒搅拌,红色变浅直至消失。
步骤三:向溶液中继续滴加稀盐酸至溶液呈酸性,用玻璃棒蘸取其中溶液,在酒精灯上加热至蒸干,有白色固体产生。
[思考拓展]
(1)从下列仪器中选择步骤二中的“仪器A”,名称是 。

(2)兴趣小组认为仅从上述步骤二的现象,难以证明盐酸与氢氧化钠发生了反应。
查阅资料:(i)酚酞试液在不同的pH时变化情况如下:
|
pH |
0~8.2 |
8.2~10.0 |
10.0~14.0 |
|
颜色 |
无色 |
粉红色 |
红色 |
(ⅱ)氢氧化钠溶液的pH随浓度的降低而减小。
兴趣小组据此形成了对比实验方案以排除干扰,该对比实验方案是 。
(2)为确认步骤三中的白色固体是氯化钠而不是氢氧化钠,进行如下实验:
|
步骤 |
现象 |
结论 |
|
|
将白色固体溶于水形成溶液,均分成两等份 |
向其中一份滴加CuSO4溶液,振荡、静置 |
①无 色沉淀生成 |
白色固体不是NaOH. |
|
向另一份滴加AgNO3溶液,振荡、静置 |
出现白色沉淀 |
②白色固体是NaCl,反应的化学方程式为 。 |
|
[继续探究]
(4)图1是氢氧化钠与盐酸反应的微观示意图。从微观角度分析,氢氧化钠溶液和盐酸反应的实质是 。

(5)兴趣小组认为上述实验对反应实质缺少直观的验证。
査阅资料:(ⅲ)变色硅胶为蓝色,吸水后呈红色。(ⅳ)变色硅胶与NaOH固体充分混合,无明显现象;变色硅胶与无水醋酸(CH3COOH)充分混合,无明显现象。
兴趣小组据此设计了图2实验,验证中和反应有水生成:将无水醋酸迅速倒入装有NaOH固体和变色硅胶的试管中,并用玻璃棒在试管中不断搅拌,观察到变色硅胶由蓝色逐渐变为红色,U型管内液面左低右高。
①U型管内液面左低右高说明该反应 热量(填写“放出”或“吸收”)。
②无水醋酸由CH3COO﹣和H+构成。变色硅胶由蓝色变成红色的原因是 (用化学方程式表示)。
黄铜是由铜和锌组成的合金,可用于制造钱币、机器零件等。利用黄铜制造各种物品的过程中,会产生大量的黄铜渣,主要含有Zn、Cu、ZnO、CuO.一种利用黄铜渣获取金属铜和硫酸锌溶液的实验流程如图:

(1)下列关于黄铜的说法正确的是 。
a.黄铜不能被腐蚀
b.黄铜的硬度比铜大
c.黄铜的熔点比锌高
(2)“酸溶”过程中有气体生成,写出生成该气体的化学方程式: 。
(3)“置换”过程中需要加入过量Zn的目的是 。
(4)为进一步提高原料利用率,得到更多的铜和硫酸锌溶液,需要对流程中的“滤渣”进行处理,向滤渣中缓慢加入 (选填“稀硫酸”或“稀盐酸”)并不断搅拌,观察到 时停止加入,过滤。
(5)上述流程中,能判断锌的金属活动性比铜强的事实是 (任写一条)。
我国塑料购物袋的年消耗量很大,废弃塑料的处理亟待解决。回答下列问题。
(1)购物袋等塑料制品的大量使用,可能会造成的一种环境污染是 。
(2)小林尝试用焚烧法对某类塑料购物袋(主要成分是聚氯乙烯)进行处理,并将燃烧产物用氢氧化钠溶液进行吸收。
【查阅资料】Ⅰ.聚氯乙烯的化学式为(C2H3Cl)n。
Ⅱ.氯化氢气体会污染环境
Ⅲ.Na2CO3+CaCl2═CaCO3↓+2NaCl
①聚氯乙烯完全燃烧的化学方程式如下:
2(C2H3Cl)n+5nO2 4nCO2+2nHCl+2nX,则X的化学式为 。
②将完全燃烧后的产物,全部通入到一定量的NaOH溶液中,得到吸收液,写出氢氧化钠溶液吸收氯化氢的化学方程式 。
③小林对吸收液的溶质成分产生了兴趣,进行如下探究:
[提出问题]吸收液中溶质的成分是什么?
[进行实验1]取吸收液少许置于试管中,滴加2~3滴无色酚酞试液,发现酚酞变红色,说明溶液呈 性。
[猜想]猜想1:NaCl、NaOH、Na2CO3
猜想2:
猜想3:NaCl、Na2CO3、NaHCO3
猜想4:NaCl、NaHCO3
[进行实验2]向实验1所得溶液中,加入过量的CaCl2溶液,小林观察到 (填实验现象),最终得出结论:猜想1正确。
[交流反思]实验结束后,小林对吸收液进行无害化处理,其方案是 ,然后倒入废液缸。
咨询老师后,小林获悉废弃塑料的资源化回收是减少环境危害的最好方法。
(3)聚氯乙烯的生产需要用到氯气。工业上获取氯气的方法是电解饱和食盐水,发生反应的化学方程式为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑.某工厂需生产14.2t氯气(Cl2),至少需要氯化钠的质量为多少?(请写出计算过程)
实验创新可以使现象更明显,操作更简便。Y型管的使用能增强实验的对比性,增添实验的趣味性。某化学兴趣小组同学利用Y型管设计了如图三个实验进行探究活动,请回答下列问题。

(1)据如图1所示实验,其设计的目的是 。一段时间后,观察到Y型管右侧湿润的蓝色石蕊试纸变红,写出发生反应的化学方程式 。
(2)如图2所示实验中,一段时间后,缓慢倾斜Y型管,将右侧的稀硫酸部分倒入左侧,依据 (填实验现象),可得出结论:Zn的金属活动性比Cu强。
(3)如图3所示实验中,根据Y型管左右两侧现象对比,可得到的实验结论是 。该实验中,Y型管顶端气球的主要作用是 。
化学是一门以实验为基础的科学。根据如图所示的装置,回答下列问题。

(1)图中标有序号①的仪器名称是 。
(2)实验室用A装置制取氧气,发生反应的化学方程式是 ,在试管口放棉花团的作用是 。
(3)用双氧水制取氧气,探究石蜡燃烧的产物,应选择装置B与 、 (填字母)组合。收集过程中,检验氧气集满的方法是 。