久置的铜制品表面能生成绿色的铜锈[主要成分为Cu 2(OH) 2CO 3],某化学兴趣小组对铜生锈的条件进行了以下探究.
【提出猜想】根据铜锈的组成元素推测,铜生锈可能是铜与空气中的二氧化碳、水等物质反应的结果.
【实验设计】兴趣小组同学取打磨光量的铜丝,设计了如图所示的四个实验.

【现象分析】若干天后,发现只有D瓶中的铜丝出现绿色的铜锈,其他瓶中的铜丝均无铜锈出现.
(1)实验B、C瓶中所使用的蒸馏水是经煮沸后迅速冷却的蒸馏水,其目的是 .
(2)B瓶与D瓶中的现象对比,可以得出的结论是 .
【实验结论】由上述四个实验可分析得出,铜生锈是铜与空气中的 共同作用的结果.
【拓展探究】以锈蚀严重的废铜屑为原料,回收制取纯铜.
查阅资料:Cu 2(OH) 2CO 3+2H 2SO 4═2CuSO 4+3H 2O+CO 2↑
Cu 2(OH) 2CO 3  2CuO+H 2O+CO 2↑
2CuO+H 2O+CO 2↑
如图是该兴趣小组设计的两种回收铜的实验方案:

【分析评价】①步骤Ⅱ反应过程中发生了还原反应的物质是 (填化学式).
②步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是 .
③步骤Ⅴ过程发生反应的化学方程式为 .
④同一份废铜屑分别通过上述两种方案最终得到的铜的质量:方案一 (填">"或"="或"<")方案二.以上两种方案中,方案二优越于方案一,理由是 (任答一点).
①实验室制取二氧化碳
结合下列实验装置图回答有关问题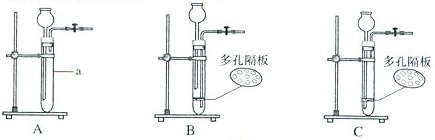
Ⅰ、仪器a的名称是________。
Ⅱ、用大理石和稀盐酸制取二氧化碳,反应的化学方程式是________。二氧化碳的收集方法是________。
Ⅲ、符合启普发生原理的装置是________(填编号)。
②制取二氧化碳后剩余溶液的成分探究(假设二氧化碳已完全放出,杂质不溶于水且不参加反应):
甲、乙两同学分析认为剩余溶液中一定含有氯化钙,可能有盐酸。为验证是否含有盐酸,他们采用了不同方法进行实验,得到了相同的结论。
查找资料:氯化钙溶液呈中性
| 实验操作 |
实验现象 |
结论 |
|
| 甲 |
取样于试管中,滴加________试液 |
试液变红 |
有盐酸 |
| 乙 |
取样于试管中,逐滴滴加碳酸钠溶液至过量 |
________ |
丙同学取样于试管中,滴加硝酸银溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,由此得出和甲、乙一致的结论。甲、乙认为丙的实验设计不合理。理由是________。
③从剩余溶液中得到尽可能多的氯化钙固体。
同学们认为加入稍过量的________(填化学式),经________、蒸发等操作后即可完成。
碳酸氢钠常用于食品和医药工业,某化学兴趣小组对碳酸氢钠的热稳定性进行探究。
[查阅资料]碳酸氢钠受热易完全分解,生成水、二氧化碳气体和一种常见固体物质,该固体物质含有三种元素,且为纯净物。
[进行实验一]为了验证碳酸氢钠受热时会分解,该兴趣小组的同学取一定质量的碳酸氢钠放到铜片上加热,如图16所示。
加热一段时间后,观察小烧杯内壁有现象,证明有水生成;通过向烧杯中加入澄清石灰水证明有二氧化碳生成。
[提出问题]碳酸氢钠充分加热后固体产物是什么?
[作出猜想]猜想Ⅰ:固体产物是Na2CO3。
猜想Ⅱ:(请完成猜想Ⅱ)。
[进行实验二]下表是该兴趣小组同学设计的实验方案,用来检验碳酸氢钠分解后固体产物的成分,请你完成方案:
| 实验操作 |
预期实验现象 |
结论 |
| 有气泡冒出 |
||
| 取少量固体样品于试管中,加入足量盐酸 |
猜想Ⅱ结论正确 |
[拓展应用]碳酸氢钠常用来治疗胃酸过多,但对于患有胃溃疡(胃粘膜溃烂)的病人在胃酸(可用盐酸表示)过多时,却不宜服用碳酸氢钠,其原因是(用化学方程式表示)。
钢铁是使用最多的金属材料。在今年的化学活动周中,某校兴趣小组的同学在老师指导下做了二个有关铁的实验。
实验一:用干燥纯净的一氧化碳还原氧化铁
实验装置如下图:
其中A是实验室用草酸(H2C2O4)和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是: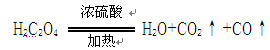 。请回答下列问题:
。请回答下列问题:
(1)B装置中发生反应的化学方程式是.
(2)C装置无明显现象,C装置的作用是。
D装置中浓硫酸的作用是 。
(3)E装置中的实验现象是。
(4)F装置的作用是、。
实验二:铝粉和氧化铁粉末反应(铝热反应)
实验装置如下图: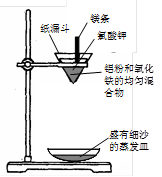
图中纸漏斗由两张滤纸折叠成漏斗状套在一起,使四周都有四层,点燃镁条后观察到的现象:镁条剧烈燃烧,发出耀眼的白光,放出大量的热,纸漏斗的下部被烧穿,有熔融物落入细沙中。
实验后老师作了如下提示:实验中镁条和氯酸钾的作用是提供反应所需的高温条件,铝粉和氧化铁粉末在高温条件下的反应叫铝热反应,属于置换反应,该反应常用于焊接钢轨。请写出该反应的化学方程式。该反应中单质铝与一氧化碳有相似的(填“氧化”或“还原”)性。
实验后同学们对金属与金属氧化物间的反应产生兴趣,激发了探究热情。
【提出问题】任何金属与金属氧化物在高温条件下都能反应吗?
同学们在请教老师后设计了如下实验方案并进行了探究。
【实验方案】
| 实验组别 |
实验操作 |
实验现象 |
结论 |
| 实验1 |
取Zn、CuO粉末的均匀混合物于密闭容器中,高温加热。 向冷却后的固体中加入足量的稀盐酸。 |
黑色粉末变成色 固体部分溶解,有气泡产生,水溶液呈无色。 |
Zn和CuO能发生置换反应。 |
| 实验2 |
取Mg、CuO粉末的均匀混合物于密闭容器中,高温加热。 向冷却后的固体中加入足量的稀盐酸。 |
发生爆炸,黑色粉末变成红色。 固体部分溶解,有气泡产生,水溶液呈色。 |
|
| 实验3 |
取Cu、Fe2O3粉末的均匀混合物于密闭容器中,高温加热。 |
粉末无变化 |
Cu、Fe2O3不能反应。 |
【实验总结】金属与金属氧化物在高温条件下有些能反应,有些不能反应。
【反思拓展】金属与金属氧化物在高温条件下反应的规律和金属与的反应相似。
葡萄糖是生命体所需能量的主要来源。
【提出问题】葡萄糖的燃烧产物是CO2和H2O,由此能否证明葡萄糖是只由碳元素和氢元素组成的有机物?
【设计实验】为了确定葡萄糖的元素组成,某小组设计了如下实验(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略)。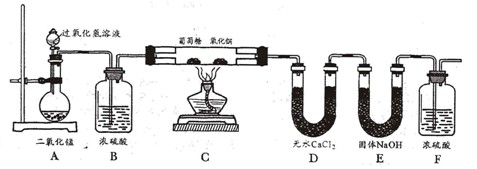
(1)装置A中发生反应的化学方程式是;
(2)装置B中浓硫酸的作用是。
(3)装置C处氧化铜的作用是。
【方案评价】
(1)用充有空气的储气球代替装置A,是否更有利于实验的进行?(填“是”或“否”)原因是。
(2)装置C处葡萄糖燃烧的设计特点是(至少一条)。
【数据处理】下表是同学们填写的实验报告,请你帮助完成。
| 实验事实 |
数据分析及结论 |
| 1.8g葡萄糖完全燃烧,得到2.64gCO2和1.08gH2O |
数据分析: 结论:葡萄糖含有C、H、O三种元素 |
【讨论交流】为了尽量减少误差:
(1)该实验在进行过程中应注意的问题是(1条)。
(2)从定量实验的角度看,该实验是否可进一步改进?请简要写出一个改进意见:。
常见的食品脱氧剂多为无机铁系脱氧剂,其主要成分为活性铁粉。脱氧中的一步主要反应为:4Fe(OH)2+O2+2H2O===4Fe(OH)3,(红褐色固体)
(1)Fe(OH)2读作;此反应的基本类型是。
(2)某同学自制脱氧剂(2g铁粉、0.5g活性炭、0.5g食盐)进行如下两个实验:
实验I: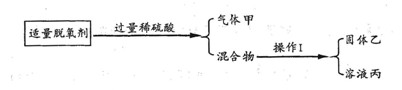
请回答:操作I的名称是;乙在净水中的作用;溶液丙中含有的溶质是(写化学式)。
实验II:将乙烘干后进行如下实验,物质之间的转化关系如下图(部分产物略去)。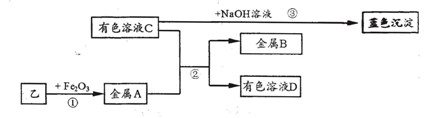
①反应①的条件是;
②金属A与B的活动性:AB(填“>”、“<”或“=”);
③区别溶液C与溶液D中物质的方法是;
④反应③的化学方程式为:;向溶液C中加入BaCl2溶液,有白色沉淀产生。其化学方程式为。