按要求填空:
(1)溶洞里形态各异的钟乳石的形成过程可简单理解为:石灰岩长时间缓慢的“溶解”在水中,水在滴落时又缓慢的生长出钟乳。钟乳石生长的化学方程式为 ,其反应类型为 。
(2)汽车尾气中含有多种氮的氧化物和一氧化碳,对空气有污染作用。有人设计在尾气处加装高效催化剂,将其转化成无污染的一种单质和一种化合物。则生成的化合物的化学式为 ,反应中化合价降低的元素符号是 。
(3)侯德榜是我国杰出的化学家,他发明的联合制碱法大大提高了原料的利用率。联合制碱的主要反应原理:向饱和的食盐溶液通入过量的氨气(易溶于水的碱性气体)和二氧化碳气体,反应后分离出碳酸氢钠。反应方程式为:NaCl(饱和)+NH3+H2O+CO2=NaHCO3+NH4Cl
向饱和的食盐溶液是先通入氨气还是二氧化碳? (填化学式)。该反应属于复分解反应,该反应能够发生的依据是 。
(4)已知某铁的氧化物可表示为FexOy=aFeO•bFe2O3.经测:15.2克的某铁的氧化物中铁的质量为11.2克。则x:y= ,a:b= (均填最小整数比)。
用下列物质的序号填空。
①干冰 ②碳酸氢钠 ③熟石灰
(1)发酵粉中含有 。
(2)用于人工降雨的是 。
(3)用于改良酸性土壤的是 。
从某废旧电子产品中可以提炼贵重金属,并得到硫酸铜溶液。其工艺流程如图所示:

(1)图中“操作”的名称是 。
(2)写出所得贵重金属中任意一种成分的化学式 。
(3)写出①中发生的化学反应方程式 (任写一种);该反应的基本类型为 。
(4)写出②中发生的化学反应方程式 。
化学的学科特征是在原子、分子水平上研究物质和创造物质。请从微观的角度回答下列问题。
(1)物质的结构决定性质。
①根据Na、Al原子结构图Na 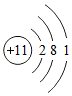 、Al
、Al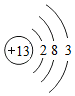 可推知,金属Na、Al的化学性质不同的原因是 。
可推知,金属Na、Al的化学性质不同的原因是 。
②CO和CO2化学性质不同的原因是 。
③稀盐酸和稀硫酸都可使紫色石蕊试剂变红,原因是 。
(2)如图是氢气在氧气中燃烧的微观示意图(图中“o”代表氢原子。“●”代表氧原子)。
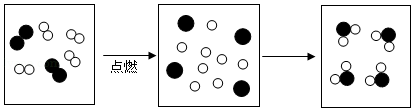
①参加该化学反应的最小粒子是 ( 填微粒符号)。
②写出该反应的化学方程式 。
酸、碱、盐的溶解性表是学习化学的重要工具之一。下表是部分酸、碱、盐在水中的溶解性(20℃),请回答下列问题。
|
阴离子 阳离子 |
OH﹣ |
NO3﹣ |
CO32﹣ |
Cl﹣ |
|
K+ |
溶 |
溶 |
溶 |
溶 |
|
Ba2+ |
溶 |
溶 |
不 |
溶 |
|
Cu2+ |
不 |
溶 |
不 |
溶 |
(1)上述阴、阳离子形成不溶性碱的化学式为 ,形成复合肥料的化学式为 。
(2)KOH溶液和Ba(NO3)2溶液 (填“能”或“不能”)反应,理由是 。
(3)下列各组离子在水溶液中能大量共存的是 。
A.OH﹣、H+、Ba2+、NO3﹣
B.OH﹣、Ba2+、K+、Cl﹣
C.CO32﹣、K+、Ba2+、Cl﹣
D.CO32﹣、Cu2+、NO3﹣、K+
抗击“新型冠状病毒肺炎”疫情是一项长期的工作。我们要采取有效防疫措施,免受病毒侵害。
(1)我们每天要补充蛋白质提高自身免疫力。下列食物富含蛋白质的是 (填字母序号)。
A.鸡蛋 B.米饭 C.白菜 D.西瓜
(2)用医用酒精进行室内消毒时,若不慎引起小面积失火,可用湿布扑灭。其灭火主要原理是 。
(3)医用口罩的中间层是聚丙烯熔喷布,起过滤病毒作用。聚丙烯属于 (填“有机合成”或“复合”)材料。生产出的外科医用口罩需用环氧乙烷进行灭菌。环氧乙烷的化学式为C2H4O.该物质中含有 种元素,其组成元素的质量比为 。