教育部从2018年开始,要求在学校普及垃圾分类回收处理的相关知识。某化学活动小组结合所学的知识对此进行一系列实践活动。
Ⅰ.活动探究
(1)学会识图分拣垃圾:下列垃圾应投入带有如图图标的垃圾箱内的是 (填字母序号)。
| A. |
塑料瓶 |
| B. |
果皮 |
| C. |
碎瓷片 |
(2)学会检验有害气体:含氯塑料焚烧时会产生氯化氢等气体。若要检验焚烧后的气体中有氯化氢,可将其通入 溶液中,有白色沉淀生成即可。
Ⅱ.实验探究:
[提出问题]如何回收处理废旧电池中的镉?
[查阅资料]
(1)废旧电池中含有镉、汞等元素,这些元素会危害人类健康。
(2)镉(Cd)从溶液中析出时呈海绵状固体。在化合物中通常表现为+2价。
(3)碳酸镉(CdCO 3)、氢氧化镉[Cd(OH) 2]都是白色固体、难溶于水。
[设计实验]先将废旧电池进行处理以制得硫酸镉( CdSO 4)溶液,用于以下实验。
实验设计 |
实验步骤 |
实验现象 |
实验结论 |
与金属反应 |
取少许溶液于试管中,加入足量的Zn粉,充分反应。 |
|
Zn可以置换出Cd |
与碱反应 |
取少许溶液于试管中,加入足量的NaOH溶液,充分反应。 |
产生白色沉淀 |
用化学方程式表示为 。 |
与盐反应 |
取少许溶液于试管中,加入足量的 溶液,充分反应。 |
产生白色沉淀 |
可用该试剂除去CdSO 4. |
[回收处理]
实验结束后,将反应后的混合物通过过滤、洗涤、加热,进而再制得镉。
[交流反思]
请同学们基于化学视角说明垃圾分类回收处理的重要意义 (答一点即可)。

在150g烧杯中加入100g过氧化氢溶液,再向其中加入2g二氧化锰。充分反应后,称得烧杯和剩余物质总质量为250.4g。请完成下列分析及计算:
(1)二氧化锰在反应中起 作用。
(2)计算过氧化氢溶液中溶质的质量分数。
研究物质的溶解对于生产、生活有着重要意义。
①下表是硝酸钾的部分溶解度数据。
|
温度(℃) |
20 |
40 |
60 |
80 |
|
溶解度(g/100g水) |
31.6 |
63.9 |
110 |
169 |
由表中数据可知,硝酸钾的溶解度随温度升高而 (选填"变大"或"变小")。60℃时硝酸钾饱和溶液中,溶质与溶剂的质量比为 ,能将该饱和溶液转化为不饱和溶液的一种方法是 。
②探究20℃时配制硝酸钾溶液过程中,溶质质量分数与加入水的质量关系。
向硝酸钾中分批加水,充分搅拌,现象如图所示
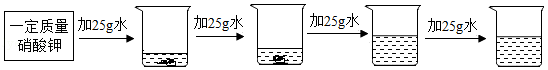
坐标图中,符合实验结果的描点可能是 (选填编号)。
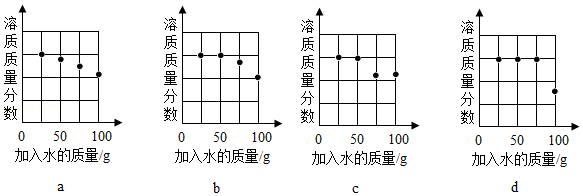
③取等质量甲和乙两种物质(均不含结晶水)进行如图所示实验,最终烧杯中析出固体的质量乙大于甲。
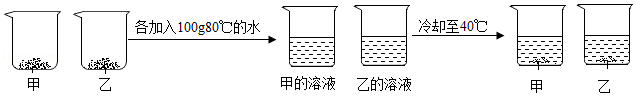
40℃时,甲的溶解度 (选填"大于""等于"或"小于")乙的溶解度。根据本实验结果,能否判断40~80℃间甲、乙哪种物质的溶解度变化随温度影响更大 (选填"能"或"不能")。
在学习了元素化合物知识后,小丽构建了以下知识网络,并对它进行了推理和判断。A~E是初中化学常见的五种不同类别的物质,E是提取量最高的金属。他们之间的关系如图所示,"﹣"表示相连的物质能发生反应,"→"表示一种物质能生成另一种物质(部分反应物、生成物和反应条件已略去)。
请回答下列问题:
(1)D的化学式是 (写一个),D和E反应的现象是 。
(2)B的化学式是 (写一个),A和B反应的化学方程式为 (写一个)。

小青和同学们一起完成了氢气燃烧的实验,并绘制了该反映的微观示意图。

请你和她讨论下列问题:
(1)图中①的微观实质是 ,②的微观实质是 。
(2)图中方框内表示纯净物的是 (填字母序号)。
氦气
氦气(He)在空气中含量甚微.通常它是一种无色无味的气体,它的密度为0.1785克/升,大约氢气的2倍,空气的七分之一.氦气的化学性质稳定,不易燃不易爆,使用十分安全.
近年来在塑料及合成纤维工业上,诞生了一种特殊的生产工艺,是氦气的微泡摻入塑料或合成纤维.制成特别轻盈的泡沫塑料或纤维,例如,风靡一时的"太空服"轻巧,保暖性好,就是因为它的纤维中含有氦气微泡.氦气也可作为焊接金属和冶炼金属时的保护气.
在标准大气压下,液氦的沸点是﹣268.9℃,固态氦的熔点为﹣272.3℃,它与"绝对零度"(﹣273.15℃)仅一步之遥,因此,液氦可称得上是"世界上最冷的液体"了.液氦的这种超低温特性,在生产与科学研究上有很重要的应用.
依据短文回答问题:
(1)氦气代替氢气灌充飞艇,利用氦气的物理性质是 ,化学性质是 .
(2)摻入氦气微泡的泡沫塑料属于 材料,区分羊毛和制作"太空服"的合成纤维,方法是 .
(3)通过阅读你已经了解了氦气的一些用途,除此之外,请再举一例氦气的可能用途 .