NaOH是重要的化工原料,研究其制备、检验、贮存及应用具有重要意义。
(1)工业上常用电解饱和食盐水的方法制取NaOH,反应的化学方程式为2NaCl+2H 2O 2NaOH+Cl 2↑+X↑.X的化学式为 。
(2)为了探究NaOH样品中是否存在NaCl、Na 2CO 3杂质,设计如下实验方法 
注:AgCl是白色固体,难溶于水和稀HNO 3
①乙中有无色无味气体产生,证明样品中含有Na 2CO 3.产生气体的化学方程式为 。
②试剂X为 溶液;可证明NaCl存在的现象是 。
(3)某兴趣小组试图通过测定生成的CO 2质量,确定因久置而变质的NaOH固体中Na 2CO 3的质量分数,设计了图所示装置并进行如下实验:
步骤一:取一定质量的样品,加入气密性良好的锥形瓶中,然后在分液漏斗中加入足量的稀硫酸,称出装置总质量为m 1。
步骤二:打开分液漏斗旋塞,逐滴加入稀硫酸,待气泡不再产生时,关闭旋塞,称出装置总质量为m 2。

①球形干燥管中不用NaOH固体而用CaCl 2固体的原因是 。
②小明同学认为(m 1﹣m 2)即为生成的CO 2质量,小红同学认为小明的想法不合理,理由是 。
(4)某工厂化验室用20%NaOH溶液洗涤一定量石油产品中残余H 2SO 4,共消耗NaOH溶液20g,洗涤后的溶液呈中性。这一定量石油产品中所含H 2SO 4的质量为 (写出计算过程,否则不得分)。
根据电解水的实验装置图完成下列问题: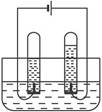
通电分解水的简易装置
(1)指出电源的正、负极,左边为___________,右边为___________,事先往水里加少量硫酸,目的是为了_________________________。
(2)左试管中产生的是___________,检验该气体的方法是__________________________;右试管中产生的是___________,检验该气体的方法是_________________________________。由以上实验事实得出结论:说明水是由_________________________________组成的。
如图A是电解水的简易装置,图B为电解水生成气体体积与时间关系图,试完成下列问题: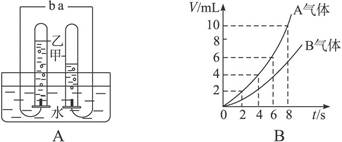
(1)若甲管生成气体A,则b应接电源___________极。
(2)气体B以带火星的木条检验,产生的现象是__________________,说明气体具有的性质是_________________。
(3)实验室可用什么方法收集氢气和氧气?这是根据气体的什么性质?
(4)4分钟后,甲、乙排除管内水的体积比各为多少?
氢气是一种没有___________、没有___________的气体,___________溶于水,密度比空气___________,是相同条件下密度最___________的气体,所以命名为氢气。氢气具有___________性,在空气(或氧气)中燃烧时,放出大量的___________,产生___________火焰,在其火焰上方罩一冷而干燥的烧杯,烧杯内壁有___________出现。需要注意的是,混有一定量空气或氧气的氢气遇明火会发生爆炸,因此,点燃氢气前,一定要___________。用排水法或向下排空气法收集一试管氢气,用拇指堵住试管口,靠近火焰,然后移开拇指点火,如果发出尖锐的___________表明氢气不纯,声音很小则表明氢气较纯。
水的电解
通电分解水的简易装置
(1)实验现象:与电源相连的两极上都有___________产生,且与电源正极相连的一端产生气体体积少,与负极相连的一端产生气体体积多,正、负极产生的气体体积比约为___________。
(2)气体检验:用___________检验乙管中的气体,发现木条复燃,说明是氧气。用___________检验甲管中的气体,能燃烧,火焰是淡蓝色,是氢气。
某化学科技小组在实验室中对一烧杯浑浊的河水进行了简单净化。请完成操作中的有关问题:
(1)先向烧杯中加入适量明矾粉末,这是利用明矾溶于水后生成的胶状物对杂质的_______,使杂质_______来达到净水的目的。
(2)再进行过滤液体:
①过滤操作所必需的仪器_________。
A烧杯 B酒精灯 C铁架台(带铁圈) D试管
E玻璃棒 F漏斗 G托盘天平 H蒸发皿
②玻璃棒的作用是___________________,玻璃棒下端接触的部分是__________层滤纸处。
③若滤液仍然浑浊,你认为其原因可能是______________________________。
(3)再用活性炭除去水中的异味,这是利用了活性炭的__________作用。
(4)最后进行蒸馏:
①蒸馏时加入沸石的目的是___________;加热烧瓶,注意不要使液体沸腾得太剧烈,以防__________________________。
②所得蒸馏水是____________________(填“硬水”或“软水”),检验的简单方法是______
___________________________________________________________。