水是生命之源,是“永远值得探究的物质”,人类从未停止过对水的研究。
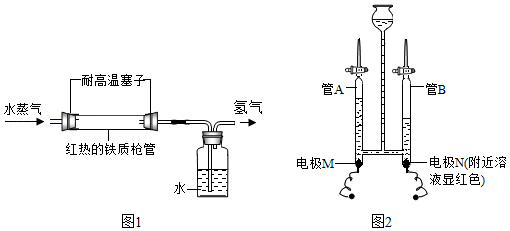
(1)1766年,英国化学家卡文迪许用锌和稀硫酸制得“可燃空气”,他所说的“可燃空气”成分是 (填化学式)。“可燃空气”在纯氧中燃烧生成水,可得出“水是一个结合物而不是简单元素”。
(2)1785年,拉瓦锡将水蒸气通过红热的铁制枪管将水转化为氢气,同时生成四氧化三铁,实验示意图如图1所示。上述反应的化学方程式为 。该反应若生成1g氢气,则理论上铁制枪管应增重 g。
实验发现枪管实际增重比理论数值大,其可能的原因是 。
(3)1800年,英国化学家尼科尔森通过电解水得到氢气和氧气,后人不断研究和改进该实验。现有某同学在水电解器中加入含酚酞的稀Na2SO4溶液,至充满管A和管B(Na2SO4溶液呈中性且不参与反应)。通直流电一段时间后现象如图2所示。电解结束后将容器内所有液体倒入烧杯中,溶液呈无色。
①下列说法正确的是 (填字母)。
a.硫酸钠在水中形成自由移动的Na+和SO42﹣,可增强水的导电性
b.电解过程中化学能转化为电能
c.电极N与电源负极相连
②电解后,管A中生成的微粒有 (填微粒符号)。
(4)当温度、压强分别超过临界温度(374.2℃)和临界压强(22.1MPa)时的水称为超临界水。现代研究表明:超临界水能够与氧气以任意比例互溶,由此发展了超临界水氧化技术。550℃时,测得乙醇(C2H6O)的超临界水氧化结果如图3所示。

注:δ(分布分数)表示某物质分子数占所有含碳物质分子总数的比例。
如δ(CO)
图中CO的分布分数先增后降的原因是 、 。
小红同学用碳酸氢钠作为膨松剂蒸馒头时,发现蒸热后的馒头有气孔,但膨松效果一般;在妈妈的建议下,小红在使用碳酸氢钠的同时加入一定量的食醋,蒸熟后的馒头膨松效果就理想多了,小红对碳酸氢钠作为膨松剂的作用原理进行探究。
[提出问题]碳酸氢钠作为膨松剂的作用原理是什么?
[查阅资料]膨松剂是在食品加工过程中加入的,因产生气体,能使面胚发起形成多孔组织,从而使食品具有松软或酥脆特点的一类物质,化学膨松剂中通常含有碳酸氢钠。
[做出猜想]小红同学对用碳酸氢钠在两次制作慢头过程中的作用原理做出猜想:
猜想一: 。
猜想二: 。
[方案设计与实施]
小红同学分别对猜想一和猜想二设计了实验方案并实施验证。
试剂和用品:碳酸氢钠、稀盐酸、澄清石灰水(仪器和其他用品自选)
|
实验方案 |
实验现象 |
结论 |
|
|
实验一 |
如图,取一定量碳酸氢钠于试管a中,加热,将产生的气体通入澄清石灰水中 |
试管a内壁有小液滴,导管口有气泡冒出,澄清石灰水变浑浊 |
猜想一正确 |
|
实验二 |
|
|
猜想二正确 |
[解释与结论]①依据小红同学对碳酸氢钠作为膨松剂的作用原理的实验探究,获得碳酸氢钠的两个化学性质是① ② (用化学方程式表示)。
②在有酸性物质存在时,碳酸氢钠作用效果会更好的原因是 。
[评价与反思]①小红妈妈制作馒头时,在面团发酵后,常加入少量纯碱来调节面团的酸度。小红提出:能不能单独使用纯碱做膨松剂?要解决该问题需要设计实验验证纯碱是否具有 的性质。
②市售膨松剂大多是复合膨松剂,一般由三类物质组成:碳酸氢钠、酸性物质、助剂(淀粉等)。结合上述探究,下列关于复合膨松剂的说法中,不正确的是 (填序号)。
a.复合膨松剂保存时要注意防潮
b.复合膨松剂在加水揉面与蒸馒头的过程中均起到发面的作用
c.使用复合膨松剂前必须先将面进行发酵
d.在蒸馒头时复合膨松剂中助剂的作用可能是调节气体产生的速率
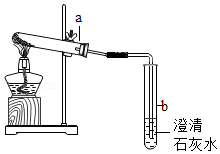
某实验小组设计如图所示装置,进行气体的制备和性质实验
实验试剂(用品):大理石、氯化钠、二氧化锰、硝酸铵固体、稀盐酸、过氧化氢溶液、蒸馏水、木条、火柴、酒精灯。
选择合适的试剂(用品)按如下步骤进行实验。
(1)组装仪器, (填必要的操作),加入药品。
(2)关闭止水夹,推动注射器,注入液体,观察到装置A中有大量气泡冒出,气球胀大。
(3)打开止水夹,观察到装置B中导管口有气泡冒出,澄清石灰水未变浑浊,装置A中产生气体的化学方程式为 要进一步确认该气体的成分还需进行的操作是 ,取下装置B中双孔塞,将红热的细铁丝由上到下缓慢地伸入到B装置的玻璃瓶中,细铁丝剧烈燃烧,写出反应的化学方程式 。
(4)更换装置A中的固体和液体药品,重复步骤2中的操作,能观察到相同的实验现象。打开止水夹,观察到装置B中导管口有气泡冒出,澄清石灰水变浑浊,写出装置B中反应的化学方程式 ,装置A中选择的固体和液体分别为 和 。
(5)继续更换装置A中的药品重复上述操作,观察到装置A中没有气泡冒出,气球变瘪。装置A中选择的固体和液体分别为 和 。

铝、铁、铜是生活中常见的金属。

(1)铝、铁、铜三种金属都能作导线,是因为它们都具有 。
(2)铝在空气中不易被锈蚀,是因为 (用化学方程式表示)。
(3)铜锈的主要成分为碱式碳酸铜[Cu2(OH)2CO3],由此我们可以得到铜生锈是铜和氧气、水、 共同作用的结果。
(4)某同学用如图所示装置,设计实验验证铝、铁、铜三种金属活动性强弱。(每步反应金属均有剩余)
若甲试管中无明显现象,乙试管中的金属b为 时可以验证三种金属活动性强弱,丙试管中反应的化学方程式为 若金属a、b、c依次为铁、铝、铜时,则无法比较 和 的活动性强弱。
阅读下面材料,回答问题。
硫元素广泛存在于自然界中,在火山口附近有硫单质存在,地球表面的含硫化合物主要以矿物质形式存在,如石膏(CaSO4•2H2O)、芒硝(Na2SO4•10H2O)等。硫单质是一种淡黄色的固体,不溶于水,易溶于二硫化碳(CS2)。火山喷发时,部分硫元素转化成硫化氢气体;部分硫元素转化成二氧化硫和三氧化硫气体,二氧化硫在大气中易被氧化成三氧化硫,二氧化硫和三氧化硫溶于水,分别生成亚硫酸和硫酸。
(1)从物质类别和硫元素化合价角度,对硫及其化合物进行分类,根据表中物质组成规律,补充缺项。
|
物质类别 |
单质 |
氢化物 |
氧化物 |
酸 |
盐 |
|
化学式 |
S |
H2S |
SO2 |
H2SO3 |
|
|
SO3 |
H2SO4 |
Na2SO4 |
(2)结合材料中硫单质的性质分析,如果洗去粘在试管壁上的硫,应选用的试剂是 。
(3)硫化氢中硫元素的化合价为 ;硫化氢的水溶液称为氢硫酸,氢硫酸露置在空气中与氧气发生置换反应,产生淡黄色沉淀,写出化学方程式 ;氢硫酸敞口放置在空气中,溶液的pH (填“增大”“减小”或“不变”)。
(4) 从物质类别的角度预测, 下列物质与二氧化硫 、 三氧化硫均能发生化学反应的是 (填序号)。
a.O2 b.NaOH c.H2O d.HCl
(5)H2SO3不稳定,易分解产生气体(与H2CO3类似)。写出稀硫酸与亚硫酸钠(Na2SO3)溶液发生复分解反应的化学方程式 。
水是生命之源,水和溶液在日常生活、工农业生产中有着重要的意义。
(1)现有蒸馏水和硬水各一杯,区分两者应选用的试剂为 。
(2)夏季空调冷气吹到的地方可以看到“冷气雾”。试从微观角度解释这一现象 。
(3)某种水培植物所需营养液中含有K+、NH4+、NO3﹣、PO43﹣,若用两种溶质配制该营养液,可选用钾肥的化学式为 (任填一种)。
(4)盐酸左氧氟沙星是常用抗菌药物,其注射液溶质质量分数不超过10%,若每瓶含盐酸左氧氟沙星固体0.4g,则使用时至少需加入生理盐水 mL(密度约为1g/mL)。
(5)工业从卤水(海水晒盐后的母液,含有MgCl2、NaCl、MgSO4、KCl)中提取KCl的流程示意图如图1所示
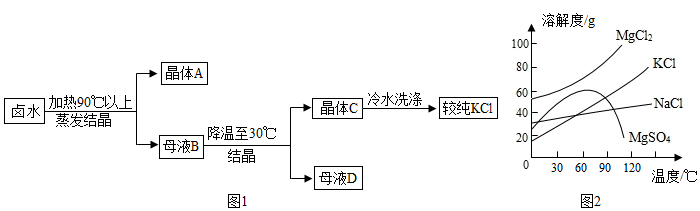
根据图2溶解度曲线信息,晶体A中含有的物质化学式为 和 ,用冷水冲洗晶体C的目的是除去 (填化学式)。