水产养殖的速效增氧剂“鱼浮灵”的主要成分是过氧碳酸钠(aNa2CO3•bH2O2)。
某化学研究小组对“鱼浮灵”的制备、成分测定及增氧原理进行了如下探究。
【查阅资料】①过氧碳酸钠有Na2CO3和H2O2的双重性质;50℃开始分解。
②过氧碳酸钠在异丙醇(有机溶剂)中的溶解度较低。
Ⅰ.“鱼浮灵”的制备。
实验室用Na2CO3与稳定剂的混合溶液和30%的H2O2溶液反应制备过氧碳酸钠,实验装置如图所示。
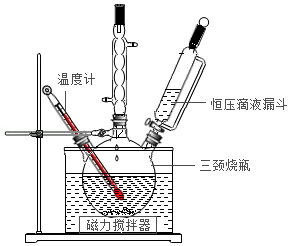
(1)反应温度不能超过20℃的原因是 。
(2)反应结束后,停止搅拌,向反应液中加入异丙醇,静置过滤、洗涤、干燥,获得过氧碳酸钠固体。加入异丙醇的目的 。
Ⅱ.“鱼浮灵”的成分测定。
【定性检测】检测过氧碳酸钠溶液中的成分。
(3)请补充完成下列实验报告中的相关内容。
实验序号 |
实验步骤 |
实验现象 |
解释或结论 |
① |
取样,加入MnO2粉末,用带火星的木条伸入试管内 |
木条复燃 |
反应的化学方程式
|
② |
|
|
溶液中含有Na2CO3 |
【定量研究】测定“鱼浮灵”中过氧碳酸钠的组成。
实验③:称取一定质量的“鱼浮灵”样品于小烧杯中,加适量水溶解,向小烧杯中加入足量Ba(OH)2溶液,过滤、洗涤、干燥,得到碳酸钡(BaCO3)固体3.94g。
实验④:另称取相同质量的“鱼浮灵”样品于锥形瓶中,加入足量稀硫酸,再逐滴加入高锰酸钾溶液,充分反应,消耗KMnO4的质量为1.896g,该反应的原理是:2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2↑+8H2O。
(4)计算确定过氧碳酸钠(aNa2CO3•bH2O2)的化学式(写出计算过程)。
Ⅲ.“鱼浮灵”的增氧原理。
研究小组通过测定常温下相同时间内水溶液中溶解氧的变化,探究CO32﹣、OH﹣对H2O2分解速率的影响,设计了对比实验,实验数据记录如下表。
编号 |
① |
② |
③ |
④ |
⑤ |
试剂 |
H2O |
4%H2O2溶液 |
Na2CO3固体 4%H2O2溶液 |
NaOH溶液 4%H2O2溶液 |
NaOH溶液 4%H2O2溶液 |
pH |
6.96 |
6.01 |
8.14 |
8.15 |
9.26 |
溶解氧 (mg•L﹣1) |
5.68 |
6.44 |
9.11 |
9.12 |
10.97 |
(5)由实验②可知,常温下,过氧化氢水溶液呈 (填“酸性”“中性”或“碱性”)。
(6)过氧碳酸钠可以速效增氧的原理是 。
某兴趣小组同学将100g氢氧化钠溶液分五次加入到139.6g硫酸铜溶液中,测得实验数据如下表所示:
|
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
|
|
氢氧化钠溶液的质量/g |
20 |
20 |
20 |
20 |
20 |
|
沉淀质量/g |
4.9 |
9.8 |
m |
19.6 |
19.6 |
(1)表格中m的值为多少。
(2)计算恰好完全反应时所得溶液中溶质的质量分数。(写出计算过程)
实验是学习化学的一条重要途径,通过实验以及对实验现象的观察,记录和分析,可以验证物质的化学性质。小明为了参加化学学科实验操作考试,在实验室练习了两个鉴别类的实验:“鉴别盐酸,氢氧化钠溶液和蒸馏水”“鉴别氢氧化钠溶液、氢氧化钙的溶液”,请完成下列各题:
(1)小明只用无色酚酞试液也将三种物质鉴别出来了,实验过程如下。请完善表格中的相关内容:
|
操作步骤 |
实验现象 |
实验结论 |
|
用A、B、C三只试管分别取三种待测液各5mL,分别滴入1﹣2滴无色酚酞试液,振荡 |
|
C是氢氧化钠溶液 |
|
将上面变色的溶液分成两份, |
A试管中无明显现象,B试管中观察到的现象是 |
A是蒸馏水,B是稀盐酸,请写出该步骤中发生反应的化学方程式 |
(2)小明又用吹气的方法鉴别出了氢氧化钠溶液和氢氧化钙溶液。鉴别完毕,他将上述所有实验的废液全部倒入一个洁净的大烧杯中,得到无色溶液,请回答下列问题:
①该无色溶液中一定没有的阴离子 (填离子符号)。混合过程中一定会观察到的现象是 。
②该无色溶液中可能含有的溶质是 (填化学式)。为了检验可能存在的物质,小明取无色溶液约2mL,加入镁条,若无明显现象,则没有该物质;若观察到有气泡产生,则一定有该物质存在,请写出该反应的化学方程式 。
(3)根据小明的实验,你能得出盐酸的化学性质有 (用字母填空)。
A.能与碱反应
B.能与活泼金属反应
C.能与碳酸盐反应
D.能与金属氧化物反应
E.能使无色酚酞试液变色
根据下列实验装置回答有关问题。(温馨提示:无水CaCl2具有吸水性)

(1)写出仪器X的名称 。
(2)实验室用装置A制取O2,反应的化学方程式为 ,其中黑色固体的作用是 ,收集装置可选择 ,若用F装置收集,验满的方法 。
(3)硫化氢(化学式为H2S)是一种无色,其有臭鸡蛋气味的有毒气体,密度比空气大,易溶于水,其水溶液呈酸性,与稀盐酸的化学性质相似。实验室可用CaS固体与稀硫酸在常温下制取,若要制取一瓶干燥的H2S气体,正确的装置连接顺序为 →H(用A、B……填空)。装置H的作用是吸收多余的H2S气体,防止污染空气,反应的化学方程式为 。
亚硝酸钠是一种工业用盐,外形与食盐相似,有咸味,有毒。人若误食会引起中毒,甚至致人死亡。已知亚硝酸钠的水溶液呈碱性,食盐水溶液呈中性。
(1)鉴别亚硝酸钠和氯化钠,你会选用什么试剂? ,如何操作? 。
(2)某实验小组成员李雷从人教版普通高中教科书《化学1》中得知碳酸钠的水溶液也呈碱性。该组成员就碳酸钠溶液呈碱性的原因进行了如下初探:
【查阅资料】
Ⅰ.大多数可溶性的盐溶解在水中会完全解离,产生自由移动的阴阳离子。如Na2CO3、KCl等。
Ⅱ.难溶性物质在水中解离出的阴阳离子极少,忽略不计。如CaCO3、BaCO3等。
Ⅲ.CaCl2的水溶液呈中性。
【猜想与假设】猜想Ⅰ:碱性是由溶液中解离出的Na+引起的;
猜想Ⅱ:碱性是由溶液中解离出的CO32﹣引起的;
………………
【实验设计】
|
实验步骤 |
实验现象 |
|
向1支洁净的小试管中加入3mL饱和碳酸钠溶液,滴入3滴酚酞溶液,振荡,再逐滴滴入氯化钙溶液至过量 |
试管中溶液颜色先由无色变为红色,然后逐渐变浅至消失 |
写出上述实验步骤中滴入CaCl2溶液后红色变浅至消失的原因 (用化学方程式解释)。
【实验结论】 。
【实验拓展】据此判断下列物质的水溶液可能使酚酞溶液变红的是 (填字母)。
A.CaCl2
B.CaCO3
C.H2SO4
D.K2CO3
【总结反思】该组同学善于发现问题,并设计实验探究问题。通过本次探究,他们认识到,并不是碱溶液才显碱性,盐溶液也可能呈碱性。他们还会进一步查阅资料探寻碳酸钠溶液呈碱性的本质原因和基本规律。
如图是实验室制取气体的几种发生装置和收集装置。回答下列问题:

(1)仪器名称① 。
(2)实验室既可用于制取氧气又可用于制取二氧化碳的发生和收集装置的组合为 (填字母),用该发生装置制取氧气的化学方程式为 。
(3)已知NO难溶于水,常温下很容易与空气中的O2反应生成NO2.实验室制取NO,应选用的收集装置为 (填字母)。气体应从 端(填“f”“j”“h”或“i”)通入。
(4)实验室常用氯化铵和氢氧化钙两种固体混合物在加热条件下制取NH3,可选用的发生装置为 (填字母)。