以MnO2为原料制备MnSO4•H2O的工业流程如图。
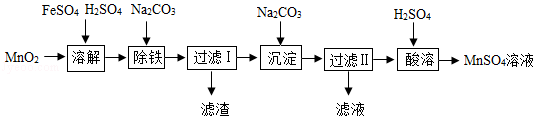
已知:①沉淀时的化学方程式为7MnSO4+7Na2CO3+11H2O=MnCO3•6Mn(OH)2•5H2O↓+7Na2SO4+6CO2↑
②MnSO4•H2O和MnSO4•5H2O易溶于水,难溶于乙醇。
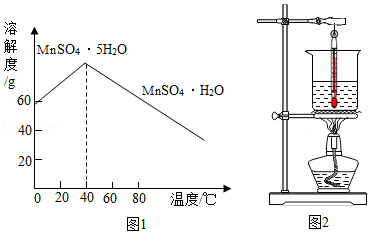
③MnSO4的溶解度曲线如图1所示。
(1)溶解时,为控制80℃,在实验室可用水浴加热如图2.水浴加热需要的玻璃仪器有酒精灯、 、 。水浴加热的优点有 。能加快溶解的方法有 (写一种)。
(2)除铁时需要搅拌,搅拌的作用是 。
(3)过滤I所得滤液的溶质主要是Na2SO4和 。过滤时,玻璃棒的作用是 。
(4)酸溶时,MnCO3•6Mn(OH)2•5H2O与足量稀硫酸反应的化学方程式为 。
(5)请补充完整由流程中“酸溶”所得MnSO4溶液制备MnSO4•H2O的实验方案:将MnSO4溶液转移至蒸发皿中, ,在高于40℃时趁热过滤, ,100℃烘干得MnSO4•H2O。
用符号表达式表示以下化学反应,并判断反应类型红磷在空气中燃烧; 反应常温下,铝具有很好的抗腐蚀性能,是因为铝在空气中与氧气反应,其表面生成一层致密的氧化层(三氧化二铝)薄膜。
请用对应的化学用语(化学符号、化学式、名称)表示:
(1)2个氢原子_____________
(2)2个钠离子____________
(3)氯化铝__________
(4)N2O5________________
(5)氧气中氧元素的化合价____________
(6)4CO2中“4”的含义_____________;“2”的含义_____________________
小明用下图A所示装置测定空气中氧气的含量.
(1)实验时,取下橡胶塞,点燃红磷后迅速伸入集气瓶中并旋紧橡胶塞,这时看到的现象是_____________,该反应的符号表达式为______________.
(2)小明又设计了如图B所示的改进装置,其中A是底面积为50 cm3、高20cm的圆筒状玻璃容器(带密封盖),上面标有以cm为单位的刻度.B是带刻度的敞口玻璃管(其他辅助装置略)。他们的操作过程如下:
a.检查装置的气密性;
b.加入水并调整B的高度.使A中的液面至刻度15 cm处;
c.将过量的红磷平铺在惰性电热板上。盖紧密封盖;
d.通电加热红磷,待充分反应后.冷却到原来的状况,调整B的高度使容器A、B中的液面保持水平,记录液面刻度。(注:A容器内固态物质所占的体积忽略不计)
①在操作a中检查装置气密性的方法是。
②在操作d结束时,装置A 中液面的刻度约为cm(填整数)。如果在操作d结束时,装置A中液面刻度在11cm处.则实验结果比理论值(填“偏大”或“偏小”)。
③改进后的装置的优点是______________.
化学是一门实验科学。我们可以通过观察肉眼可见的实验现象,再加上分析推理,来认识分子的性质和确认分子的真实存在。
【实验理解】(1)用如图所示的装置进行实验:
在大烧杯罩住的两个小烧杯中,分别盛有
A.浓氨水和酚酞溶液
B.酚酞溶液和酚酞溶液
C.浓氨水和浓氨水
(2)本实验用到对照的方法,起对照作用的是不变色和变色。
(3)实验中可以直接观察到的项目是
A.氨分子的质量和体积都很小
B.氨分子在不断运动
C.氨分子之间有间隔
D.A烧杯和B烧杯内的溶液都变红
E.A烧杯内的溶液变红
【实验延伸】某同学对浓氨水使酚酞溶液变红的速度发生了浓厚的兴趣,并设计了以下探究实验:
①制备“标准色”溶液:取浓度为20%的5mL浓氨水、20mL酚酞溶液注入小烧杯,并给小烧杯蒙上塑料薄膜。
②另取适量药品用一只大烧杯和两只小烧杯仿照上图进行实验,观察并测定酚酞溶液变成“标准色”所需的时间。
【问题探究】
(4)给“标准色”溶液的小烧杯蒙上薄膜的作用是。
(5)想尽快使酚酞溶液变成“标准色”的方法有多种,一种方法是,还有一种方法是。
实验室常用下列装置来制取氧气:
(1)写出图中有标号仪器的名称:a、b;
(2)用双氧水和二氧化锰来制取氧气时,可选用的发生装置是(填序号),其中二氧化锰起作用,反应的符号表达式为。此方法制取氧气最好,其优点。
(3)用高锰酸钾制取氧气,可选用的装置是(填序号),要在试管塞一团棉花,目的是,发生反应的符号表达式为。
(4)收集氧气时不宜用D装置,其原因是。
(5)用C装置收集氧气的优点是。