实验室以某石灰石(含少量Fe2O3)为原料制备高纯CaCO3的步骤如下。
溶解 向石灰石样品中加入适量盐酸,至反应完全。
除铁 加入氨水调节pH,然后加入适量Ca(OH)2,充分反应后过滤。
沉淀 向滤液中补充氨水,通入CO2,反应一段时间。
分离 过滤、洗涤、干燥得高纯CaCO3。
(1)溶解时,CaCO3、Fe2O3分别与盐酸反应的化学方程式为 、 。判断样品已完全反应的实验现象是 。
(2)除铁时,选用Ca(OH)2而不选用NaOH,其主要原因是Ca(OH)2价格低且来源广、 、 ;过滤所得滤渣的主要成分为 。
(3)沉淀时,其他条件相同,反应温度对CaCO3产率的影响如图。高于35℃时,CaCO3产率下降的主要原因是 、 (4)分离时,若向过滤所得滤液中加入 (填化学式)并加热,则可回收NH3。
(5)该实验中可以循环利用的物质有H2O和 。
(6)石灰厂煅烧石灰石生产CaO,若要得到28t CaO,则至少需要含CaCO3 90%的石灰石多少吨?(写出计算过程,保留一位小数。)

马强和张勇在实验室用下列装置制取氧气气体。
(1)写出图中标有①、②、③的仪器名称①___________ ②_____________ ③______________
(2)马强选择用某纯净物制取氧气,则他应选用的发生装置为________(填序号),该反应的文字表达式是_______________________,如果马强选用E装置收集氧气,则他的理由是________________________,他判断氧气已收集满的方法是___________________。
(3)如果张勇选择用B装置制取氧气,则他选用的药品是_________________,反应的文字表达式是___________________________________,如果张勇选择用排空气法收集氧气,则应选择__________装置。
从分子,原子角度分析并解释下列问题。
①一滴水中大约含有6.7×1021个水分子:___________________________________
②糖放在热水中比冷水中溶解更快:________________________________________
③将50ml的水与50ml的酒精混合,所得溶液体积小于100ml____________________
看图填空。
右图所示某原子的核电荷数为_________,核外有_____个电子层,最外层上有个_____电子,在化学反应中该原子容易______(填“得到”或“失去”)电子而变成_______(填“阴”或“阳”)离子,从而达到____________的结构,该原子在分类上属于___________(填“金属”、“非金属”或“稀有气体”)的原子。
按要求写出符合题意的化学反应的文字表达式。
①有黑色固体物质生成的化合反应:___________________________
②有无色无味气体气体生成的氧化反应:_______________________
③用氯酸钾制取氧气:_______________________
④生成有刺激性气味气体的反应:_____________________________
、根据下列实验装置图,回答有关问题,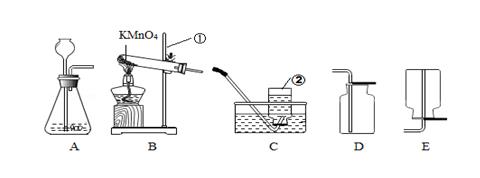
(1)写出装置中标号仪器的名称① ;② 。
(2)实验室利用过氧化氢溶液和二氧化锰制氧气应选择的发生装置为____ (填字母),若要获得较纯净的氧气,应选择的收集装置是_____ ,二氧化锰在反应中起 作用。
(3)若用B装置作制氧气的发生装置,应进行的改进是 ,写出高锰酸钾制氧气的文字或符号表达式 。
(4)实验室用高锰酸钾制取氧气的主要步骤有:①装药品;②检查装置气密性;③固定装置;④加热;⑤收集气体;⑥撤酒精灯;⑦从水槽中撤出导管。正确的操作顺序为()
| A.②①③④⑤⑥⑦ | B.②①③④⑤⑦⑥ |
| C.①②③④⑤⑦⑥ | D.①②③④⑤⑥⑦ |
(5)下列装置中能用于收集氧气的装置是______________(填编号)。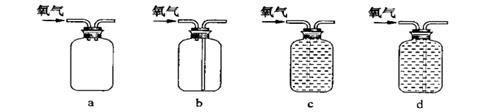
(6)氢气是一种密度最小、难溶于水的气体,实验室用颗粒状的锌和稀硫酸在常温下反应即可制得氢气,我们可为其选择的装置组合是______。