工业生产的纯碱中常含有少量氯化钠杂质,下列装置是测定纯碱在该混合物中质量分数的实验方法之一。(碱石灰为CaO和NaOH的固体混合物)
①检查装置气密性;
②称量干燥管 I及其干燥剂的总质量为100g;
③将称量好的纯碱样品 12g放入广口瓶 B 中,关闭分液漏斗旋塞;
④在未连接干燥装置之前先通入空气几分钟,然后关闭开关 a,再连接好干燥装置;
⑤从分液漏斗中缓慢加入稀硫酸至不再产生气泡,关闭分液漏斗旋塞:
⑥打开开关a,缓慢鼓入空气几分钟后,再称量干燥管 I的质量为104.4g.
(1)最初鼓入空气的目的是排除装置A、B、C 中的空气,防止测定结果________(填“偏大”、“偏小”)。
(2)装置C的作用是______________。
(3)装置A中一定发生的反应方程式为。
(4)装置B中发生的反应方程式为。
(5)纯碱样品中碳酸钠的质量分数是________(结果精确到0.1%)。
下图是小华同学用氢氧化钠固体和水配制500g溶质质量分数2.5%的NaOH溶液的操作过程,该同学在称量氢氧化钠时,先将天平调节平衡,然后在两个托盘上各放一张质量相同的纸,把药品直接放在纸上称量。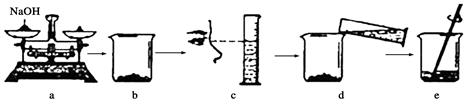
(1)根据上述实验,请回答:
①a操作的错误是。
②下列操作中导致溶质质量分数偏低的是(填字母)。
| A.a操作中砝码和氢氧化钠放错盘 |
| B.b中烧杯用水洗涤后未干燥就使用 |
| C.c操作中视线与量筒凹液面最低处保持水平 |
| D.d操作中有少量水溅出 |
(2)小华在测定所配制溶液的酸碱度时,先将pH试纸用蒸馏水湿润,再进行测定,则测的溶液的pH值______(选填“偏大”、“偏小”或“不受影响”).
(3)小华将上述溶液稀释成0.2%做电解水实验,用检验正极产生的气体。若将100g稀释后的氢氧化钠溶液电解,实验后溶液中氢氧化钠的质量分数变为0.25%,有g水被电解。(已知氢氧化钠可增强水的导电性,在通电前后质量不变)
下面是初中化学中的重要实验,请回答下列问题: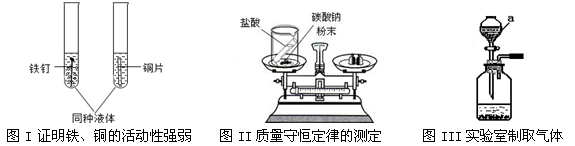
(1)若图I中加入的液体为无色,则该无色液体可以是
(2)图II实验前后天平(填“是”、“否”)平衡。
(3)图III中仪器a的名称是,
利用图III通过发生复分解反应制取气体的化学方程式为
甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题。
(1)t1℃时,甲、乙、丙物质的溶解度由大到小的顺序是_____。
(2)t2℃时,将20g甲放入50g水中充分搅拌所得溶液为溶液(填“饱和”或“不饱和”)。
(3)t2℃时,乙物质的饱和溶液中溶质与溶剂的质量比为______。
(4)t3℃时,将乙和丙两种物质的饱和溶液降低到t1℃,所得溶液中溶质的质量分数大小关系为:乙_____丙(填“>”、“<”或“=”)。
如图表示某些物质间转化关系(反应条件和部分产物已省略)。其中A、E为固体氧化物,且A为黑色粉末;B、D是由相同元素组成的无色液体,且B具有消毒杀菌作用;C、Y、Z为无色气体,其中Y有毒;X是最常见的金属。请回答下列问题: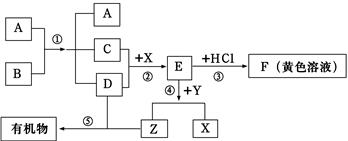
(1)应①中A物质的作用是______;溶液F中的金属离子是(用符号表示)。
(2)写出下列化学方程式:③_________________④_________________
(3)在日常生活中为防止反应②的发生,可采取的措施是_________________
(4)在自然界中普遍存在反应⑤,其名称为_________________