金属及其化合物在生产生活中有广泛的应用。

(一)金属的应用和防护
(1)用不锈钢、合成橡胶、氧化镁等材料制造的飞机轮胎属于 材料。
(2)航空煤油是飞机的燃料,它主要是由 炼制的。
(3)铁易生锈,提出防止铁生锈的一种方法 。
(4)特种钢中含有少量Mn、MnO2和Al粉混合在高温下反应可得到Mn,该反应的化学方程式为 。
(5)Mg(OH)2受热分解生成高熔点的MgO.Mg(OH)2可用作阻燃剂,其主要原理是 (选填序号)。
a.分解吸热,降低可燃物着火点 b.MgO覆盖燃烧物,隔绝氧气
(二)制备还原性铁粉
实验室利用废铁屑(含少量Fe2O3)为原料制备还原性铁粉的流程如下:
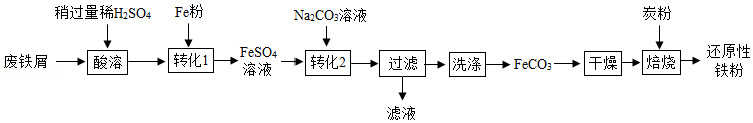
(1)Fe粉可使“酸溶”产生的Fe2(SO4)3转化为FeSO4,该反应的化学方程式为 。
(2)检验FeCO3已洗净的方法:取最后一次洗涤后的滤液,先加入一定量稀盐酸,再滴加 溶液,无明显现象。
(3)“干燥”时有少量FeCO3发生下列转化:FeCO3 FeOOH+CO2,该转化的化学方程式为 。
(4)“焙烧”前,应将炭粉与“干燥”所得固体均匀混合,目的是 。
(三)测定还原性铁粉的组成
还原性铁粉中含有少量FexCy,小组同学在老师的指导下进行以下实验。
资料:①Fe,FexCy在加热时与O2反应能生成相应氧化物。
②FexCy不与酸反应。
实验1:取29.52g样品,加入足量稀H2SO4,充分反应后生成1.00gH2。
实验2:另取29.52g样品,按如图进行实验。

表:装置A和B的质量变化
装置 |
A |
B |
反应前 |
300.00 |
400.00 |
反应后 |
m |
400.44 |
实验后A中固体全部变为红棕色,装置A、B的质量变化如上表。
(1)装配好装置后,实验前先要 。
(2)装置C的作用是 。
(3)FexCy中,x:y= 。表中m的值是 。
反思:若用空气替代O2进行实验,测得x:y的值偏大,可能的原因是 。
娄底人在端午节有吃皮蛋的习俗。某化学小组的同学查阅资料后得知,腌制皮蛋的主要原料有:生石灰、纯碱和食盐。同学们向这三种物质中加入适量水,充分搅拌,过滤,对滤渣中溶质的成分进行探究。
小组同学讨论后一致认为,滤液中的溶质一定含有NaCl和 。(写化学式)
【提出问题】滤液中还可能含有哪些溶质呢?
【作出猜想】
小林认为:还含有Ca(OH)2
小方认为:还含有Na2CO3
小华认为:还含有Ca(OH)2和Na2CO3
【交流讨论】经过进一步讨论,大家认为小华的猜想不合理,原因是: 。(用化学方程式表示)
【实验探究】
|
实验操作 |
实验现象 |
实验结论 |
|
小林:取少量滤液于试管中,滴加足量的稀盐酸 |
|
小方的猜想正确 |
|
小方:取少量滤液于试管中,滴加 溶液 |
产生白色沉淀 |
小方的猜想正确 |
|
小华:取少量滤液于试管中,滴加Na2CO3溶液 |
无明显现象 |
小方的猜想正确 |
【交流谈论】同学们认为,通过小华的实验不足以得出其结论,原因是 。
【继续探究】小明也取少量滤液于试管中,滴加稀盐酸,却没有看到明显现象,小明对此深感疑惑。
【解释评价】经老师的指导和大家的认真思考后终于找出了原因,你认为是 。最后,老师对同学们这种严谨的科学态度给予了充分的肯定。
图甲装置是实验室常用装置,请按要求回答下列问题:
(1)请写出仪器①的名称 。
(2)实验室可用高锰酸钾制取氧气,该反应的化学方程式为 。欲用该方法制取一瓶较纯净的氧气,要选择的发生装置和收集装置是 。(填字母序号)
(3)实验室用E装置来收集CO2,验满的方法是 。
(4)实验室在常温下用块状电石和水反应制取乙炔气体,由于该反应十分剧烈,实验必须严格控制反应速率,你认为图甲中最适宜的发生装置是 。(填字母序号)
(5)图乙所示装置具有多种用途,下列有关它的用途说法中,正确的是 。(填字母序号)
A.该装置用于排空气法收集氢气时,气体应从a端管口通入
B.瓶内装满水,用于收集氧气时,气体应从a端管口通入
C.瓶内装入适量浓硫酸用于干燥CO2时,气体应从a端管口通入
D.瓶内装满氧气,要将氧气排出,水应从a端管口通入

某同学在实验室用氯酸钾和二氧化锰的混合物制取氧气,并对反应后固体剩余物进行回收、利用,实验操作流程及数据记录如下

请回答下列问题:
(1)滤液可作化肥使用,你认为它属于 肥;
(2)该同学制得氧气的质量 g;
(3)计算滤液中溶质质量分数。
根据下列装置图,回答问题:

(1)用高锰酸钾制取氧气,选用的发生装置是 (填序号),为防止高锰酸钾粉末进入导管,该装置需做一点改进的是 ,若用D装置收集氧气,当观察到 时,便可开始收集。
(2)实验室制取二氧化碳用选用的一组装置是 (填序号),反应的化学方程式是 ,图G是某同学利用报废试管设计的制二氧化碳的发生装置,该设计除了废物利用的优点外,请另写一个优点 。
(3)用收集的氧气完成图E铁丝燃烧的实验,集气瓶中预先放少量水的原因是 ;如图F向装满CO2的软塑料瓶中注入约 体积的水,立即旋紧瓶盖,振荡,观察到的现象是 。
体积的水,立即旋紧瓶盖,振荡,观察到的现象是 。
某同学配制50g 6%的氯化钠溶液,整个操作过程中如图所示,回答下列问题:

(1)配制溶液的正确操作顺序为 (填序号,下同),其中操作错误的是 。
(2)图②中盛放氯化钠固体的仪器名称是 ,需称取氯化钠 g。
(3)量水时选用的量筒的量程最合适的是 (填序号),读数时视线要与量筒内 保持水平。
A.10mLB.25mLC.50mLD.100mL
(4)取上述溶液10g加水 g,可稀释得到3%的NaCl溶液。
(5)若该同学配制的溶液溶质质量分数偏小,可能的原因是 (填序号)。
A.氯化钠固体不纯B.用生锈砝码称量
C.装瓶时有少量溶液洒出D.溶解前烧杯内有少量水