在实验室利用下列仪器进行制取气体的实验。请回答下列问题:
(1)写出图中标号⑦仪器的名称 。
(2)利用氯酸钾和二氧化锰的混合物制取并收集氧气,反应的化学方程式为 。需要选择上图中的仪器有 (填数字序号,下同),还需要补充的一种玻璃仪器是 ,向气体发生装置内加入药品前应进行的操作是 。
(3)实验室制取二氧化碳的发生装置需选择上图中的仪器有 。若用装置⑨收集二氧化碳气体,气体应从 (填“a”或“b”)端导管进入。
化学与生活息息相关,请用化学知识解释下列问题:
(1)加热冷水,当温度尚未达到沸点时,为什么水中常有气泡冒出? 。
(2)从灭火原理角度回答,为什么用扇子扇蜡烛火焰一扇就灭? 。
(3)衣服通常是由纤维织成的,涤纶、锦纶(尼龙)和腈纶属于合成纤维,请写出一条合成纤维的优点 。
在化学兴趣小组的活动中,老师让甲同学给大家表演了一个小魔术:"清水变牛奶,牛奶变雪碧"。A、B、C三种溶液分别是稀盐酸、氢氧化钙溶液、碳酸钠溶液中的某一种。
【实验活动】

[交流讨论]同学们根据新奇的现象展开了热烈的讨论。
乙同学:"清水变牛奶"就是无色溶液中产生白色浑浊。
丙同学:"牛奶变雪碧"就是白色浑浊消失,溶液中产生大量的气泡。
大家都点头认同。
[提出问题]甲同学:A、B、C分别是什么?为什么能出现上述现象呢?
[解释结论]丁同学:根据步骤2的现象可确定C为 (填名称)。
戊同学:产生步骤1现象的原因是 (用化学方程式表示),但还无法确定A、B各是什么。
[实验证明]己同学:另取A于试管中,把C滴加到A中观察到的现象如图2所示,因此他断定A是 (填化学式)溶液、同时也确定了B。
[深入交流]甲同学:步骤1加入B时,溶液中CO 3 2 ﹣的数目变化趋势曲线应该是 (如图3,填a或b)。
[总结归纳]上述实验活动涉及的这类化学反应,只有当两种化合物互相交换成分, 时,复分解反应才可以发生,除此之外还可能生成 ,且反应前后没有 (答一点)。
小组活动结束,老师为同学们的探究意识和探究能力点赞。
如图2为某钙片的商品标签,为测定钙片中钙元素的质量分数(假设钙片中其他物质不含钙元素,且不溶于水,也不与任何物质发生反应),某化学兴趣小组取20片钙片,进行如下实验:
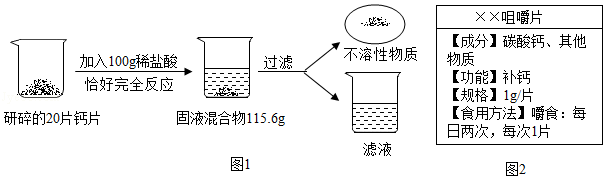
(1)上述实验过程中发生反应的化学方程式为 。
(2)根据已知条件列出求解所加的稀盐酸中溶质质量(x)的比例式 。
(3)用36.5%的浓盐酸配制100g上述稀盐酸,所需浓盐酸的质量为 。
(4)钙片中钙元素的质量分数为 。
(5)若向滤液中加入5.4g水,所得溶液中溶质的质量分数为 。
(6)工厂生产钙片时若需碳酸钙120t,理论上需含氧化钙84%的生石灰的质量为 。
北宋沈括编撰的《梦溪笔谈》中,记录了用CuSO4溶液熬制胆矾的铁釜,使用时间久了也可以化作铜。
(1)由上述材料分析,Fe比Cu的金属活动性 (填“强”或“弱”)。
(2)如果向足量的CuSO4溶液中加入5.6g Fe粉,充分反应后,理论上可以得到Cu的质量是多少?
结合某校师生线上“互动探究”活动,回答有关问题。
[学习目标]了解生活中常见的几种盐的化学性质。
[实验用品]教师用品:NaCl溶液、Na2CO3溶液、酚酞溶液、CaCl2溶液、KNO3溶液等。
学生用品:洁厕灵(主要成分稀盐酸,不考虑其它成分)Ca(OH)2溶液(用生石灰干燥剂制备)、纯碱(Na2CO3)溶液、小苏打(NaHCO3)溶液、注射器、废塑料瓶、吸管等。
[互动探究]
|
探究目的 |
探究过程 |
主要现象 |
解释或结论 |
|
探究一:盐溶液是否一定显中性 |
教师实验: 向分别盛有NaCl溶液、Na2CO3溶液的两支试管中滴加 溶液 |
所加溶液遇NaCl溶液不变色,遇Na2CO3溶液变红色 |
盐溶液不一定显中性 |
|
探究二:Na2CO3溶液和NaHCO3溶液能否与某些酸溶液反应 |
|
有 产生,Ca(OH)2溶液变浑浊 |
Na2CO3溶液和NaHCO3溶液能与某些酸溶液反应 |
|
探究三:Na2CO3 溶液能否与某些 溶液反应 |
|
产生白色沉淀 |
写出化学方程式 |
|
探究四:Na2CO3溶液能否与某些盐溶液反应 |
教师实验: (1)取少量KNO3溶液于试管中,向其中滴加Na2CO3溶液 (2)取少量CaCl2溶液于试管中,向其中滴加Na2CO3溶液 |
(1)无明显现象 (2) |
Na2CO3溶液能与某些盐溶液反应 |
[拓展延伸]“垃圾是放错了位置的资源”,对下列物质的利用,正确的是 。
A.“探究一”中剩余溶液的混合液,可用于检验“探究二”中洁厕灵是否过量
B.“探究二”中生成的这种气体,可以作为气体肥料
C.“探究三”中生成的这种固体,可以作食品干燥剂
D.“探究四”中剩余溶液的混合液,可以除去NaNO3溶液中混入的Ca(NO3)2