学习了碳酸钠的性质后,小莹和小雨各取三支试管做了如下实验。
(1)试管A中酚酞溶液变为红色,说明碳酸钠溶液显 性。
(2)试管B中的实验现象为 。
(3)试管C中发生反应的化学方程式为 。
实验结束后,小莹和小雨将各自三支试管中的物质分别倒入①号、②号烧杯中,静置一段时间后观察到如下实验现象,请分析:
编号 |
实验现象 |
实验分析 |
①号烧杯 |
溶液呈红色,且有白色沉淀 |
溶液中的溶质一定有 (填除指示剂外的全部溶质,下同) |
②号烧杯 |
溶液呈无色,没有白色沉淀 |
溶液中的溶质一定有 ,可能有HCl |
为了确定②号烧杯中可能含有的溶质是否存在,小雨同学继续进行探究。
[实验验证]
取②号烧杯中的溶液于试管中,加入锌粒后,观察到 ,说明溶质中含有HCl。
[讨论交流]
下列试剂中可以代替锌粒达到探究目的的是 (填字母序号)。
A.Fe2 O3 B、CO2 C、Cu
[实验反思]
两位同学讨论后一致认为,两烧杯中出现不同现象的原因是反应物的用量不同。

A~F是初中化学常见的物质。各物质之间的相互关系如图所示,图中"→"表示转化关系(部分反应物、生成物、反应条件已略去)。已知A是大理石的主要成分,F只含两种元素。请用初中所学化学知识回答下列问题: 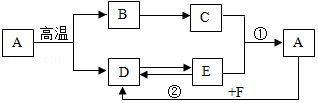
(1)写出C在农业生产中的用途: 。
(2)写出固态D的名称: 。
(3)写出反应①所属的基本类型: 。
(4)写出反应②的化学方程式: 。
如图所示,将白磷和红磷分装于Y形试管的两个支管中,管口系牢小气球将两个支管同时伸入相同深度的热水中。请回答下列问题:
(1)燃烧的是 (填“a”、“b“或“c”)处,该处燃着的磷会很快熄灭,原因可能是 (填序号)。
A.温度降低
B.氧气耗尽
C.试管内产生了二氧化碳气体
D.着火点升高
(2)管口的小气球可以防止 (填名称)进入空气,从而使该实验绿色化。
(3)热水的作用是 和 。

A~G是均含有一种相同元素的物质,其中A、B、C、D是不同类别的物质且相对分子质量(化学式量)依次减小,G与碱反应有气体生成。它们之间有如图所示的转化和反应关系(“→”表示某一种物质经一步反应可转化为另一种物质,“﹣”表示相连两种物质能发生化学反应,部分反应物、生成物及反应条件已略去)。
(l)从物质的分类分析,物质A属于 (填“酸”、“碱”、“盐”或“氧化物”)。
(2)D、E是由相同的元素组成的物质,E的化学式是 。
(3)写出下列反应的化学方程式
D→C: ;B→G: 。

海水“晒盐”得到的粗盐,含有氯化镁、氯化钙、硫酸钠等可溶性杂质,必须对其进行分离和提纯,才能用于工业生产和人们的日常生活.某实验小组设计如下流程除去粗盐中的可溶性杂质,得到氯化钠晶体.请回答下列问题.

(1)步骤II加入的物质有:①过量的碳酸钠溶液、②过量的氢氧化钠溶液、③过量的氯化钡溶液,正确的加入顺序有三种,请你把它写出来(用物质前的序号表示),第一种: ;第二种: ;第三种: .
(2)步骤 IV的实验操作是 .
(3)工业上电解饱和氯化钠溶液可制得烧碱,同时还有氯气和氢气生成.该反应的化学方程式为 .
取碳酸钡和硫酸钡的混合物23.0g于烧杯中,将150.0g的稀盐酸平均分三次加入烧杯中,加入稀盐酸的质量与烧杯中固体的质量关系如图所示,计算:
(1)该混合物中硫酸钡的质量为 g
(2)恰好完全反应时所得溶液中溶质的质量分数(精确至0.1%)
