某化工厂用3.7t的熟石灰处理溶质质量分数为2%的硫酸废液,待测得废液pH=7时再进行排放。理论上这些熟石灰可以处理硫酸废液质量是多少?
用溶质质量分数为5%的NaOH溶液中和73g的稀盐酸,反应过程中溶液的酸碱度变化如图所示。请计算
(1)用质量分数为10%的氢氧化钠溶液配制5%的氢氧化钠溶液100g,需要水 克。
(2)当a为80g时,所得溶液中溶质的质量分数是多少(结果精确到0.1%)?

断血流滴丸主含有木犀草素(化学式为C13H2Ox)等黄酮类活性成分,具有止血、抗菌、抗炎及免疫等药理活性。已知木犀草素的相对分子质量为286,请计算:
(1)x的值为 ;
(2)木犀草素中碳元素的质量分数为 (结果精确到0.1%)。
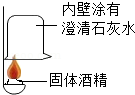
火锅是我国独创的美食,历史悠久。火锅常用的一种燃料是固体酒精。某化学兴趣小组的同学对“固体酒精”产生了好奇,对其成分进行探究。请你回答下列问题。
[查阅资料]
a.固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成。
b.氯化钙、氯化钠溶液均呈中性。
[提出问题]
①酒精中是否含有碳元素?
②固体酒精中的氢氧化钠是否变质?
[实验探究]
①按图所示进行实验,发现烧杯内壁有一层白膜,可得出酒精精中含有碳元素的结论,理由是 。
②取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀,请用化学方程式表示该沉淀是如何形成的: 由此说明氢氧化钠已变质。
③为进一步确定氢氧化钠的变质程度,分组进行探究。
甲组同学取烧杯上层清液于两支试管中,按如图所示进行实验。
|
实验方案 |
|
|
|
实验现象 |
溶液变红 |
产生 |
|
实验结论 |
清液中有氢氧化钠 |
清液中有碳酸钠 |
乙组同学认为甲组实验不能证明清液中一定有氢氧化钠,理由是 。他们另取烧杯中上层清液,加足量氯化钡溶液,充分反应后,静置,取上层清液,滴加酚酞溶液,酚酞溶液变红。
[反思交流]乙组实验中加足量氯化钡溶液的目的是 。
[实验结论]小组同学经过讨论,一致认为该固体酒精中的氢氧化钠部分变质。
结合图1化学实验装置,回答有关问题。

(1)写出图中标有字母的仪器的名称:a b 。
(2)实验室用氯酸钾制取氧气应选择的发生装置是 (填代号),可用 法收集氧气。制得的氧气用来做如图2所示的实验,发现H中铁丝不燃烧,其原因是 。写出G中反应的化学方程式 。
(3)实验室制取二氧化碳常用的药品是 ,若用装置E收集二氧化碳,则 气体应从填“①”或“②“)端进入;若要获得干燥的二氧化碳,可将装置B和装置D用胶皮管连接,并在装置D中盛放 (填物质名称)试剂。
(4)实验室常用装置C代替装置B制取气体,装置C的优点是 。
家庭食用碱的主要成分是Na 2CO 3,为测定该食用碱中Na 2CO 3的质量分数,某同学进行了以下实验取40g食用碱,平均分为四份,然后分别加入一定质量分数的CaCl 2溶液,实验数据见下表(假设该食用碱中不含难溶性杂质且杂质均不与CaCl 2溶液产生沉淀)
|
实验一 |
实验二 |
实验三 |
实验四 |
|
|
食用碱的质量 |
10g |
10g |
10g |
10g |
|
加入CaCl 2溶液的质量 |
20g |
40g |
60g |
80g |
|
生成沉淀的质量 |
3g |
m |
8g |
8g |
请分析表中数据回答并计算:
(1)m= g。
(2)40g该食用碱与足量CaCl 2溶液反应,最多生成沉淀质量为 g。
(3)该食用碱中Na 2CO 3的质量分数是多少?(写出计算过程,答案精确到0.1%)