甲、乙、丙三位同学对一瓶实验室久置的 NaOH 溶液变质程度进行实验探究。
(1)甲同学取少量该溶液于试管中,滴加 2~3 滴酚酞溶液,观察到 ,他认为该溶液未变质。
(2)乙同学查阅资料获知,Na2CO3溶液遇指示剂变色与NaOH 溶液相同,认为甲同学的检验方法不正确。乙同学取少量该溶液于试管中,加入足量稀盐酸,观察到 ,他认为已完全变质。写出此现象的化学方程式 。
(3)丙同学认为乙同学的实验结论不严谨,他的猜想是 。 他用如下实验方案来证明自己的猜想:
①取少量该溶液于试管中,先加入足量的BaCl2溶液,产生白色沉淀,说明原溶液中存在 。(填化学式)
②静置后取上层清液于另一支试管中,加入 2~3滴酚酞溶液,观察到溶液变红色,说明原溶液中存在 。(填化学式)
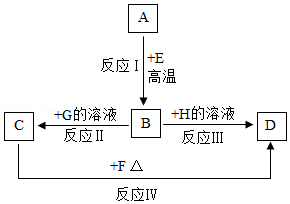
A~H是初中化学常见物质,它们之间的转化关系如图所示(部分产物已略去)。已知B是目前世界年产量最高的金属,A、E、F是氧化物,C是气体,H的水溶液呈蓝色,农业上常用来配制波尔多液,G、H的溶液中的阴离子相同。
①列举D物质的一种用途 。
②反应Ⅱ的化学方程式为 。
③写出一个符合条件的反应Ⅰ的化学方程式 。
④如图所示的转化关系中,涉及到的基本反应类型是 。
直饮水机的水处理过程如图所示。
(1)“可直接饮用水”属于 (填“混合物”或“纯净物”)。
(2)炭罐的作用是 (填选项字母)。
a.过滤
b.脱色除味
c.消毒杀菌
实验室用如图所示装置制取氧气并完成相关实验(夹持仪器已略去)。

(1)仪器①的名称是 。
(2)A装置中反应的化学方程式为 。
(3)用C装置收集气体的方法是 (填选项字母)。
a.排水法 b.向下排空气法 c.向上排空气法
(4)检验C中收集满氧气的方法是 。
(5)C中收集满氧气后,打开弹簧夹K1、K4,关闭K2、K3,其中打开K1的目的是 ,点燃D中燃烧匙内的红磷后,立即伸入C装置中并把塞子塞紧,观察到红磷燃烧的现象是 ,待红磷熄灭、C装置冷却后,打开K3,观察到的现象是 。
氢氧化钠、氢氧化钙是两种常见的碱。
(1)它们有一些相似的化学性质,其原因是溶液中都含有 。
(2)可作某些气体干燥剂的是 。
(3)用氢氧化钙溶液检验二氧化碳,反应的化学方程式为 。
(4)根据化学方程式计算,用7.4kg氢氧化钙能中和硫酸厂排放的污水中硫酸的质量是多少?
向CaCl2和HCl的混合溶液中逐滴加入Na2CO3溶液,生成沉淀的质量变化与加入Na2CO3溶液质量关系如图所示,请回答问题:
(1)生成沉淀质量为 g。
(2)求所用Na2CO3溶液的溶质质量分数(计算结果保留一位小数)
