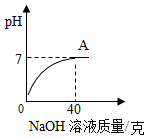
某工厂化验室用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸(该产品中其它物质不与氢氧化钠反应),消耗氢氧化钠溶液的质量与反应过程中溶液的pH值关系如图所示。
(1)图中A点表示的意义是 。
(2)求这一石油产品中残余硫酸的质量(写出计算过程)。
食用碱的主要成分是Na 2CO 3(常含有少量的NaCl).课外探究小组为测定市售食用碱中Na 2CO 3的含量,设计了如图实验装置:
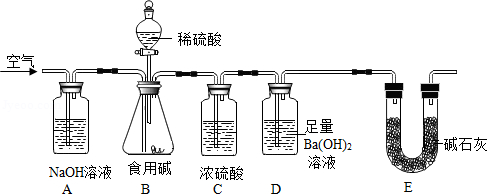
设计思路:用空气将装置B中生成的二氧化碳缓缓吹入装置D中,利用装置D的质量变化测定食用碱中Na 2CO 3的含量.请结合实验装置和设计思路,回答下面问题:
①装置D中发生反应的化学方程式为 ;
②装置A的作用是 ,装置E的作用是 ;
③缓缓通入空气的目的是 .
④若撤除装置A,直接通入空气会导致实验结果 (填"偏大"、"偏小"或"不变"),若撤除装置C,对实验结果的影响是 .
某化学小组的同学对金属元素及金属材料进行系列研究.
(1)人类文明与金属材料的发展应用关系十分密切.下列三种金属合金中,直到近代才得以应用的是 (填写序号之一).
①铜合金 ②铝合金 ③铁合金
(2)孔雀石的主要成分是碱式碳酸铜[Cu 2(OH) 2CO 3],以其为原料的炼铜方式有以下两种:①Cu 2(OH) 2CO 3═(加热)2CuO+CO 2↑+H 2O
②Cu 2(OH) 2CO 3+2H 2SO 4═2CuSO 4+CO 2↑+3H 2O
以上 ① ② 两种方式,再通过一步反应都可得到单质铜,其中不属于湿法冶铜的是 (填写序号 ①、②之一).
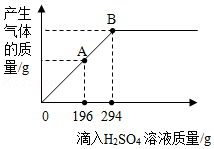
(3)已知碱式碳酸铜[Cu 2(OH) 2CO 3]难溶于水,现取33.3g的碱式碳酸铜固体,放入干净的烧杯中,逐渐滴入溶质质量分数为10%的H 2SO 4溶液,滴入该H 2SO 4溶液的质量和反应产生气体的质量关系曲线如图所示.请回答下列问题:
①当滴入上述H 2SO 4溶液196g(即图中A点)时,烧杯内溶液中的溶质质量为 g.
②当滴入上述H 2SO 4溶液294g(即图中B点)时,试通过计算,求此时所得不饱和溶液的质量.(计算结果精确至0.1g)
实验室中有一瓶无色溶液A,已知其中的溶质可能是NaOH和BaCl 2或两者之一,另有一固体混合物B,其中可能含有NH 4Cl、MgSO 4、NH 4NO 3、CuO四种物质中的两种或多种.按如图所示进行探究实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应).
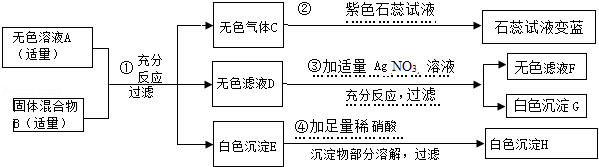
试根据实验过程和发生的现象,填写以下空白:
(1)气体C的化学式是 .
(2)根据实验现象,可以证明无色溶液A中,一定存在的金属阳离子有 种.
(3)根据上述实验现象推理,在固体混合物B中,肯定存在的物质是 (填写化学式).在无色滤液F中,一定存在的酸根阴离子有 (填写离子符号).
(4)写出步骤4中所发生反应的化学方程式: .
(5)根据上述实验现象,在固体混合物B里,所述四种物质中,还不能肯定是否存在的物质是 (填写化学式),得出此结论的理由是 .
如图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),某化学小组的同学欲利用其进行下列各化学实验。
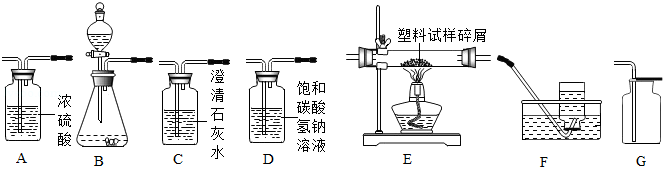
(1)用锌和稀硫酸反应制取并收集干燥的氢气,然后进行氢气的可燃性实验。
①制取氢气所发生反应的化学方程式为 。
②进行氢气的可燃性试验,点燃氢气前,一定要 。
(2)以石灰石和稀盐酸为原料,在实验室中制取并收集干燥、纯净的二氧化碳气体。按照要求设计实验装置、连接仪器,并检验装置的气密性。
①所选仪器的连接顺序为 (从左至右填写仪器序号字母)(提示:挥发出的少量HCl气体可用饱和碳酸氢钠溶液吸收)。
②二氧化碳能够扑灭木材着火的根本原因是下列的 (填写序号A、B、C、D之一)。
A.二氧化碳密度比空气大
B.二氧化碳降低了可燃物的着火点
C.二氧化碳既不能燃烧,也不支持燃烧
D.二氧化碳能与水反应
(3)以过氧化氢溶液为原料(二氧化锰作催化剂),在实验室中制取氧气,并对某种塑料试样的组成元素进行分析探究实验(资料显示该塑料只含C、H、O三种元素),所选仪器按"B→A 1→E→A 2→C碱石灰干燥管"的顺序连接,(A 1、A 2为浓硫酸洗气瓶),实验前检验装置气密性。使一定量的该塑料试样碎屑在纯氧气中充分燃烧,观察现象,收集有关实验数据(假设发生的化学反应都充分反应)。
①在该装置中,洗气瓶A 1、A 2都吸收水分,其作用的不同之处是 。
②仪器E的大玻璃管中放入的塑料试样碎屑质量为m g,塑料试样充分燃烧后,测得仪器A 2的质量增加a g,仪器C的质量增加b g,则在该塑料试样中氢、碳元素的质量之比为:氢元素的质量:碳元素的质量= (计算结果用含a、b的代数式表示)。
济南自古"家家泉水,户户垂杨",享有"泉城"美誉,第四届济南泉水节拟于9月2号开幕.保泉护泉,治理水源污染,人人有责.小涛同学为研究济南趵突泉和小清河水质状况,进行了系列探究实验.
(1)小涛同学从趵突泉中取水样过滤,取澄清滤液大约5mL置于洁净的小烧杯中,用酒精灯加热,慢慢蒸发,水分蒸干后,观察到烧杯底部有少许白色的固体残留,其原因是 .
(2)据媒体5月26日报道,在小清河泺口段有污水排入.小涛同学到现场排污口处取水样,用pH试纸检测该水样的酸碱性,正确的操作方法是 .
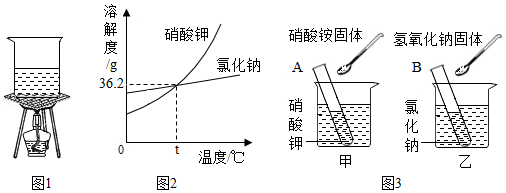
(3)小涛同学在进行探究温度对物质溶解性影响的实验时,按以下步骤进行操作(溶解度曲线如图2所示):①在t℃时,分别取3.62g硝酸钾固体和3.62g氯化钠固体分别放入A、B两支试管中,加水至固体都恰好完全溶解,此时B试管中氯化钠溶液的质量为 g(计算结果精确至0.01g).
②将A、B试管分别置于盛有等质量水的甲、乙两烧杯中(如图3所示),向甲烧杯的水中加入3药匙硝酸铵固体,向乙烧杯的水中加入3药匙氢氧化钠固体,搅拌至烧杯中固体完全溶解时,A试管中 (填写"有""无"之一)晶体析出,此时,A、B两试管内溶液中溶质的质量分数比较为A B(填写"大于""等于""小于"之一).