实验室里有一瓶氢氧化钙粉末由于较长时间敞口放置,已部分变质为碳酸钙。某课外兴趣小组为测定该瓶粉末中碳酸钙的质量分数,进行实验操作、数据收集和计算。
(1)配制稀盐酸:配制500克7.3%的稀盐酸,需要36.5%的浓盐酸 克。
(2)抽样测定:将瓶中粉末搅拌均匀后称取20克样品放入烧杯并置于电子秤上,再加入足量稀盐酸充分反应,总质量与反应时间的关系如下表所示:
反应时间/秒 |
0 |
10 |
20 |
30 |
40 |
总质量/克 |
310.0 |
309.6 |
308.6 |
307.8 |
307.8 |
完全反应后,生成的CO 2气体的质量为 克
(3)计算出该样品中CaCO 3的质量分数(要有计算过程)。
(4)经过分析讨论,同学们觉得这样测得的结果有可能偏大,原因是 (指出一点即可)
工业上常利用石灰浆[主要成分为Ca(OH)2]制备化工原料KClO3的流程如下:

已知:①反应1为:6Cl2+6Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O.
②有关物质在常温下的溶解度如下:
|
物质 |
Ca(ClO3)2 |
CaCl2 |
KClO3 |
KCl |
|
溶解度/g |
209.0 |
74.5 |
7.3 |
34.0 |
回答下列问题:
(1)在实验中两次涉及过滤操作,完成此操作需要的玻璃仪器有烧杯、玻璃棒、 ,该操作中玻璃棒的作用是 .
(2)Ca(ClO3)2的名称是 .对于反应1,参加反应的Cl2中有一部分Cl的化合价升高,另一部分降低,则化合价升高的Cl与化合价降低的Cl 的个数比为 .
(3)反应2为KCl与Ca(ClO3)2发生的复分解反应,该反应能发生的主要原因是 .溶液A中含有的溶质为CaCl2和 (填化学式).
(4)上述流程中析出的KClO3晶体表面通常吸附有Ca2+、Cl﹣等杂质离子,过滤时洗涤KClO3晶体,应选用下列中的 饱和溶液(填编号).
A.KCl B.CaCl2 C.KClO3 D.Na2CO3.
小明将未经砂纸打磨的铝条放入盛有足量稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图所示.
回答下列问题:
(1)ab段发生反应的化学方程式是 .
(2)bc段发生反应的化学方程式是 .
(3)cd段压强变化的主要原因是 .

生活中处处有化学知识.回答下列问题:
(1)人们常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有 作用.
(2)常用 检验水样是否属于硬水. 若为硬水,常采取 的方法降低硬度.
(3)炒菜时锅中的油起火燃烧,若向燃着的油锅里加水,不但不能灭火,还会使油滴飞溅出来燃烧更加剧烈,其原因是 .正确的方法是用锅盖盖灭,其原理是 .
根据图所示信息进行计算.
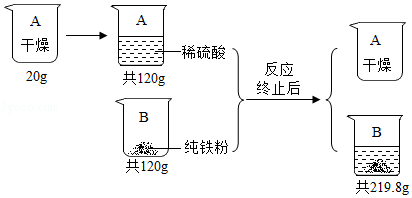
假设:稀硫酸转移完全且生成气体全部逸出.
(1)生成H2的质量为 g.
(2)反应后的溶液中溶质质量分数为多少?(写出解题过程,最后结果保留两位小数)
某化学兴趣小组欲测定一瓶过氧化氢溶液中溶质的质量分数,实验操作及相关数据如图所示:
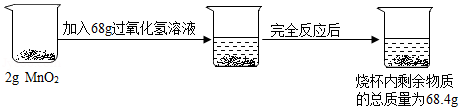
(1)生成氧气的质量 g
(2)这瓶过氧化氢溶液中溶质的质量分数是多少?(写出计算过程)