小科为测定某石灰石样品(主要成分为碳酸钙,其它成分不与稀盐酸反应)中碳酸钙的含量,利用气密性良好的图甲装置进行实验:①称取石灰石样品6克,加入锥形瓶中,塞紧瓶塞,从左侧持续缓慢鼓入空气;②一段时间后打开分液漏斗活塞,注入足量的稀盐酸,开始计时;③待装置D总质量不再增加时停止鼓入空气。实验过程中测得装置D增加的质量随时间变化图象如图乙。(碱石灰能吸收二氧化碳和水) 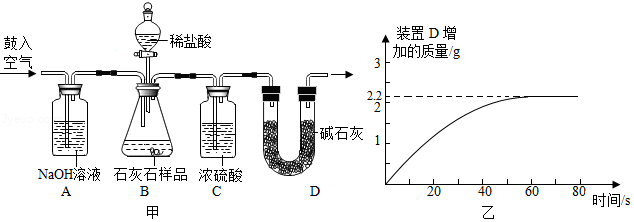
(1)根据图乙,运用化学方程式计算该石灰石样品中碳酸钙的质量分数。(计算结果精确到0.1%)
(2)下列情况中,会导致测得的碳酸钙质量分数偏大的是 。
①去掉装置A,将空气直接鼓入装置B
②去掉装置C,将B与D装置直接相连
③当气泡停止产生时立即停止鼓入空气
利用某工业废弃固体(成分为Cu 2S和FeS 2)制备硫酸铜溶液和硫酸亚铁晶体,流程如图所示。

(已知:①固体B含有氧化铜、氧化铁②铁能与硫酸铁反应,生成硫酸亚铁)
(1)操作Ⅰ是 。为了提高废弃固体的反应速率,除将固体粉碎、提高温度外,还可以采取的具体措施有 (写一条)。
(2)写出FeS 2在空气中灼烧的化学方程式 。
(3)溶液C中的溶质有 (用化学式表示)。
(4)试剂y的作用是 。
某活动小组利用以下实验装置制取氧气并进行探究活动

(1)装置A中发生反应的化学方程式是 。
(2)若用装置A、B、C来制取一瓶干燥的氧气,装置B中应盛放的是 ,导管口连接的顺序是 。
(3)活动小组对(2)收集到的气体中氧气的含量产生兴趣。于是将收集到的一瓶氧气密封。
【提出问题】这瓶气体中氧气的体积分数是多少?
【实验验证】活动小组设计了以下两套实验装置,用来测定该瓶气体中氧气的体积分数:在氮气环境下。将过量的铜粉分别装入干燥的硬质玻璃管和支试管后,密封。用两支干燥的注射器从该瓶中抽取气体,分别按图2连接,推拉注射器一段时间后,用酒精灯在铜粉部位加热,加热时反复推拉注射器至反应完全。
①甲装置比乙装置更合理,理由是 。
②用甲装置测定氧气的体积分数,需要测定的实验数据是 。
【反思交流】实验完毕,待装置冷却至室温后,应先将气球内的气体全部挤出,再读数。否则会使测得的实验结果 (填"偏大"偏小"或"无影响"),原因是 。
利用以下装置对酸的化学性质进行探究。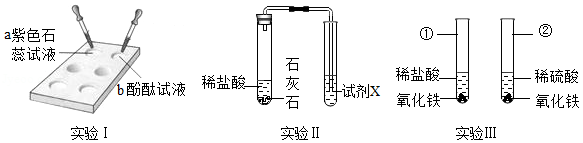
(1)标号为①的仪器名称是 。
(2)实验I中,在点滴板的a、b穴中滴入酸溶液后,溶液变红的是 (填“a”或“b”)。使用点滴板的优点之一是 。
(3)实验Ⅱ中,为了验证石灰石中含有碳酸根离子,试剂X的名称是 。
(4)实验Ⅲ中,在仪器①、②中均可观察到的现象是 、 。仪器②中发生反应的化学方程式是 。
碳酸钡是一种重要的化工产品,某厂用含二氧化硅杂质的碳酸钡原料生产碳酸钡产品,采用了以下的工艺流程:
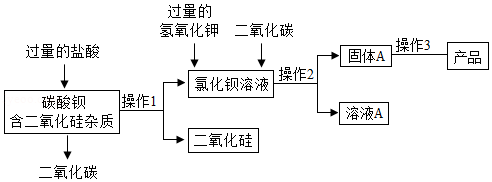
(1)为节约成本,过程中的生成物可直接应用于流程的是 ,加入过量的盐酸的目的是
(2)向氯化钡溶液中加入过量的氢氧化钾并通入二氧化碳,其中能生成碳酸钡的方程式是 。
(3)溶液A中溶质的成分,可能的组合有 。
(4)操作3包括的两个操作是 。
绿水青山就是金山银山,保护环境人人有责。
(1)目前人们利用最多的能源是煤、石油和 等化石燃料。煤燃烧会产生二氧化碳、二氧化硫、一氧化碳等气体,这些气体中,溶于雨水会形成酸雨的是 。科学家正在努力开发和利用的新能源有 、地热能、潮汐能等
(2)2018年第二十六届"世界水日",我国的宣传主题是"实施国家节水行动,建设节水型社会"。下列用水方式,符合该主题的是 (填字母序号)。
A.用淘米水浇花
B.洗脸,刷牙时,不间断地放水
C.及时修理坏的水龙头
D.农业和园林改浸灌为喷灌或滴灌
(3)我国对江河的管理实施了河长制,某条河的附近有一硫酸厂,该厂的废水经处理后排放到此河流中。假如你是该河的河长,如何检验经处理后排放的废水中是否还含有硫酸根离子。检验方法是: 。