在新型冠状病毒肺炎的防疫工作中,“84”消毒液常用于学校环境的消毒灭菌。某校兴趣小组对“84”消毒液的相关知识产生了兴趣,于是在老师的指导下进行如下探究:
【查阅资料】
a.“84”消毒液的主要成分是次氯酸钠(NaClO)和氯化钠,NaClO为有效成分。
b.次氯酸钠(NaClO)溶液有漂白、杀菌、消毒功效,有腐蚀性。
c.可通过电解氯化钠溶液的方法来制取次氯酸钠。
一、初识“84”消毒液:
【提出猜想】“84”消毒液对有色衣物有漂白作用。
【设计实验】
实验操作 |
实验现象 |
实验结论 |
向有色布条滴加适量该消毒液,放置一段时间。 |
有色布条 (填“褪色”或“不褪色”)。 |
消毒液对有色衣物有漂白作用。 |
二、自制“84”消毒液:同学们在实验室通过电解氯化钠溶液来制取“84”消毒液,其反应的化学方程式是NaCl+H2O NaClO+X↑,则X的化学式是 。
三、实验拓展:在老师指导下,同学们成功制得了“84”消毒液,激发了同学们更大的探究欲望,于是还设计了提纯粗盐(主要成分是NaCl,还含有可溶性杂质MgCl2、CaCl2等)的实验方案:
实验步骤 |
实验目的或说明 |
(1)取一定量的粗盐样品,加入适量水完全溶解,再加入过量的氢氧化钠溶液,充分反应后过滤。 |
完全除去杂质MgCl2,写出反应的化学方程式: 。 |
(2)往步骤(1)中滤液加入过量的 (写化学式)溶液,充分反应后过滤。 |
完全除去杂质CaCl2. |
(3)往步骤(2)中滤液加入过量的稀盐酸。 |
写出所得溶液中含有的阳离子符号: 。 |
把步骤(3)中所得溶液倒入蒸发血中,用酒精灯加热蒸发结晶即可得到较纯的食盐。
【实验反思】
a.此方案最终所得NaCl比原粗盐样品中的NaCl多,其原因是 。
b.有同学认为只需要上述实验方案中的步骤(2),不仅能完全除去杂质CaCl2.还能完全除去杂质MgCl2,你认为正确吗?说明理由: 。
化学是以实验为基础的科学,实验是科学探究的重要手段。根据图示回答下列问题:
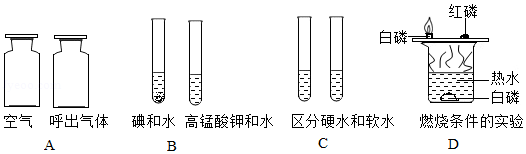
(1)A实验中,将 分别插入两个集气瓶中,比较氧气含量多少;
(2)B实验中,向两支试管中分别加入1﹣2小粒的碘和高锰酸钾,再各加入5mL水振荡,现象如图所示,由此得出的实验结论 ;
(3)C实验中,若要区分硬水和软水,向两支试管中分别加入等量的 ,生活中通过 可以降低水的硬度;
(4)D实验中,铜片上白磷燃烧,水中白磷不燃烧,由此得出燃烧的条件之一是 。
具备基本的化学实验技能是完成化学实验的基础和保证。请回答下列问题:
(1)固体药品通常盛放在 里;吸取和滴加少量液体的仪器名称是 ;
(2)用酒精灯加热试管里的液体时,液体不应超过试管容积的 ;
(3)用量筒量取8毫升水时,若仰视读数,则实际量取液体的体积 8毫升(选填"大于"、"小于"或"等于");
(4)蒸发操作时,用玻璃棒搅拌的目的是 。
"绿水青山就是金山银山",保护环境势在必行。请回答下列问题:
(1)请写出造成水体污染的原因 (答一点即可)。
(2)请写出酸雨的危害 (答一点即可)。
(3)在汽油中加入适量乙醇作为汽车燃料(车用乙醇汽油),请写出使用乙醇汽油的一条优点 。
化学是研究物质性质、组成、结构与变化规律的科学。请回答下列问题:
(1)为什么灯泡里的灯丝用钨制而不用锡制? 。
(2)生铁和钢都是铁的合金,二者性能差异很大的原因是什么? 。
(3)金刚石和石墨都是由碳元素组成,为什么它们的物理性质存在着明显差异? 。
化学与生活息息相关,请用化学知识解释下列问题:
(1)加热冷水,当温度尚未达到沸点时,为什么水中常有气泡冒出? 。
(2)从灭火原理角度回答,为什么用扇子扇蜡烛火焰一扇就灭? 。
(3)衣服通常是由纤维织成的,涤纶、锦纶(尼龙)和腈纶属于合成纤维,请写出一条合成纤维的优点 。