学习完金属的化学性质,同学们来到实验室进行锌、铜、银三种金属活动性顺序的探究活动。实验桌上老师提供的药品有:锌片、铜片、银片、硫酸锌溶液、硫酸铜溶液、硝酸银溶液和稀硫酸。
[制定计划]在老师的指导下,经过讨论,同学们设计出了以下几种实验方案:
方案一:铜片、硫酸锌溶液、硝酸银溶液;
方案二:锌片、银片、硫酸铜溶液;
方案三:锌片、铜片、硫酸铜溶液、硝酸银溶液;
你的设计方案是 。
[进行实验]小华同学选用方案三进行如下探究,请你帮他完成表格中的空白(注:表格中实验操作一栏用文字描述或图示表示均可):
实验操作 |
实验现象 |
分析与结论 |
|
。 |
金属活动性:Cu Ag(填“>”或“<”)。 |
|
锌片表面附着一层红色物质,溶液由蓝色逐渐变为无色。 |
金属活动性:Zn Cu(填“>”或“<”),反应的化学方程式为 。 |
[解释与结论]根据上述实验,小华得出三种金属活动性由强到弱的顺序是 。
[反思与评价]探究活动结束后,同学们分享自己的收获与不足,并进行反思:
1.有同学提出,小华的实验中不用硫酸铜溶液也能得到相同的实验结论。简要说明其验证方法: 。
2.经过讨论,大家一致认为以上实验方案中,方案 较好。
3.小华提出,试管中的金属可以回收再利用,这样做的意义是 。
[拓展与延伸]好奇地小华在老师的指导下,把一定量的锌粒加入硫酸铜和硝酸银的混合溶液中,充分反应一段时间后,过滤,发现滤液呈无色。此时,滤渣中一定含有 ,溶液中离子数目增加的是 。
金属材料的应用推动了社会的发展。新型材料的研制,已成为现代高新技术的重要物质基础。
(1)目前常用的1元硬币为钢芯镀镍合金,具有耐腐蚀、 等优点。
(2)镁和铝可熔炼成Mg17Al12镁合金,熔炼过程只能在真空中,不能在空气中进行的原因是 (写其中一个化学方程式)。
(3)某废弃物中可能含有Cu、CuO、Mg、Zn中的一种或几种,为确定其成分并回收金属,取样品进行如图实验。
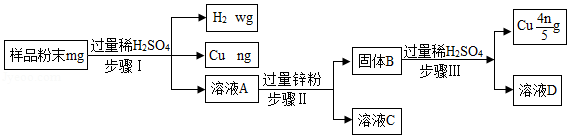
①步骤Ⅱ的操作是 。
②步骤Ⅱ中产生的现象是 。步骤Ⅲ中锌和稀硫酸反应的化学方程式为 。
③若溶液C中只含一种溶质,则样品的成分是 。
④通过测氢气的质量,也可确定样品的成分,则w的值为 (用m和n的代数式表示)。
根据如图回答问题。
(1)反应原理
①加热高锰酸钾、分解过氧化氢溶液或加热氯酸钾均可产生氧气,其中分解过氧化氢溶液和加热氯酸钾时,加入二氧化锰在反应中起的作用是 。三种方法中,写出其中一个反应的化学方程式 。
②石灰石和稀盐酸反应产生二氧化碳的化学方程式为 。
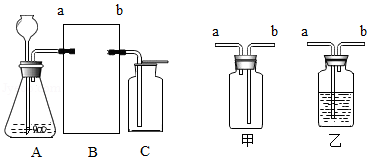
(2)制取O 2和CO 2.连接如图的装置完成实验。
|
制取气体 |
A |
B |
C |
||
|
反应物 |
装置(填"甲"或"乙") |
物质 |
作用 |
作用 |
|
|
O 2 |
① |
② |
水 |
③ |
接水 |
|
CO 2 |
石灰石和稀盐酸 |
乙 |
④ |
干燥CO 2 |
⑤ |
面对新冠肺炎疫情,要严格防控,科学消毒。体积分数为75%的医用酒精能够破坏新型冠状病毒的脂质包膜分子并使其蛋白质变性,从而杀灭病毒。
(1)乙醇(C2H5OH)俗称酒精。乙醇属于 (填“有机物”或“无机物”)。
(2)探究乙醇能溶解在水中。在盛有2mL水的试管中滴入3滴红墨水,再缓慢加入2mL乙醇,如图,补充完成实验。
|
实验操作 |
实验现象 |
实验结论 |
|
|
|
乙醇能溶解在水中形成溶液 |
(3)配制医用酒精。把100mL体积分数为95%的酒精(没有消毒作用),加水稀释为75%的医用酒精,下列仪器不需要的是 (填序号)。
A.烧杯
B.药匙
C.玻璃棒
D.量筒
(4)科学使用医用酒精。阅读下列材料。
|
物质 |
最小爆炸限度% (空气中的体积分数) |
最大爆炸限度% (空气中的体积分数) |
闪点(℃) |
|
乙醇 |
3 |
19 |
12.8(医用酒精为22) |
|
柴油 |
0.6 |
7.5 |
>62 |
闪点指的是挥发性物质所挥发的气体与火源接触下会闪出火花的最低温度。
①从燃烧的角度,结合材料中的信息简述:使用医用酒精消毒时,应避免火源引发火灾甚至爆炸的原因有 。
②在家里,使用医用酒精对门把手、桌面和文具等物品进行消毒的正确方式是 (填“擦拭”或“喷洒”)。
二氧化硫属于空气污染物,应处理后排放。32g硫与足量的氧气完全反应,生成二氧化硫的质量是多少?
某化学兴趣小组的同学对酸、碱和盐的性质进行探究,请你参与。
【查阅资料】CO2+Na2CO3+H2O═2NaHCO3;
20℃时,部分物质的溶解度。
|
物质 |
Ca(OH)2 |
NaOH |
Na2CO3 |
NaHCO3 |
|
溶解度/g |
0.16 |
109 |
21.8 |
9.6 |
探究一:探究氢氧化钙的性质
20℃时,在盛有5g Ca(OH)2固体的A烧杯中加入40mL水,用玻璃棒搅拌,静置,取上层部分清液于B烧杯中。
(1)向A烧杯中滴加几滴酚酞溶液,观察到的现象是 ,再加入过量稀盐酸,反应的化学方程式为 。
(2)向B烧杯中通入CO2,观察到澄清石灰水变浑浊。
(3)由上述实验可知氢氧化钙的性质有 。
[实验拓展]
(4)向上述(1)反应后的A烧杯中滴加碳酸钠溶液,测得其pH随反应时间的变化如图1.AB段的实验现象是 ,BC段发生反应的化学方程式为 。
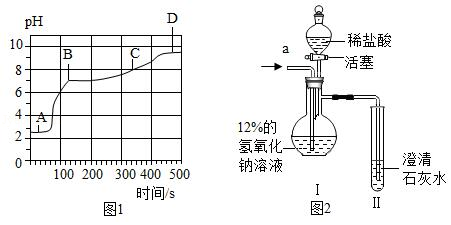
探究二:二氧化碳通入一定溶质质量分数的氢氧化钠溶液中溶质成分的探究
[设计和实验]20℃时,甲、乙两组同学设计如图2装置分别进行实验。
甲组:从a端缓慢通入CO2,一段时间后Ⅱ中变浑浊,停止通CO2,Ⅰ中溶质为X.打开活塞,滴加足量稀盐酸。
[解释与结论](1)经分析X是NaHCO3.实验过程中,Ⅰ中产生的现象是 。
乙组:从a端缓慢通入CO2,一段时间后Ⅱ中无明显现象,停止通CO2,Ⅰ中溶质为Y.打开活塞,滴加足量稀盐酸,Ⅱ中变浑浊。
[解释与结论](2)乙组同学认为Y只有Na2CO3.你认为该结论是否合理,结合分析Y的成分说明理由 。Ⅰ中一定发生反应的化学方程式为 。