某种手机电路板主要含有Fe、Cu、Ag(银)、Ni(镍)等金属及非金属基材,如图是某工厂回收金属铜的工艺流程图。已知:2Cu+O2+2H2SO4 2CuSO4+2H2O。

(1)电路板不直接焚烧而采取热风处理的主要目的是 。
(2)操作①的名称是 。
(3)写出滤液③与铁粉反应的化学方程式 。
(4)Fe、Cu、Ag、Ni在溶液中的金属活动性顺序由强到弱依次为 。
(5)写出⑤得到纯铜的一种方法 。
请从下列物质中选择适当的物质填空:(填字母,下同)
A明矾 B氮气 C 氧气 D氢气 E金刚石
(1)灯泡中充入的物质可以延长其使用寿命的是 ;
(2)用于急救病人的是 ;
(3)被称为最理想的绿色能源的是 ;
(4)常用净水剂是 ;
(5)可用于制作玻璃刀刀头的是 。
用化学符号填空
(1)空气中含量最多的元素是 ;(2)3个氨分子 ;
(3)2个亚铁离子 ;(4)4个硫酸根离子 ;
(5)硝酸铵中呈+5价的氮元素 。
我国首台使用二甲醚为燃料的城市客车有效地解决了公交车冒黑烟的问题。已知二甲醚的化学式为C2H6O。请回答:
(1)二甲醚中碳、氢元素的质量比为 。
(2)二甲醚中氧元素的质量分数为 (结果精确到0.1%)。
实验室常用如图所示的装置制取气体和气体性质的验证,回答有关问题.
(1)实验室要用氯酸钾和二氧化锰制取氧气,应选用发生装置是(填编号) ,反应的化学方程式为 ,如果进行铁丝燃烧的实验,选用的最佳收集装置是 (填字母标号);
(2)装满氧气的集气瓶应盖上玻璃片后, (填正放或倒放在桌面上;
(3)实验室用过氧化氢溶液与二氧化锰制取氧气,其反应的化学方程式为是 ,制取装置应选择
(4)若以高锰酸钾为原料,用A、C、装置制取、收集氧气时,A装置中一处明显的错误是_______;试管口略向下倾斜的原因是 。
(5)将点燃的蜡烛放入集满氧气的集气瓶中,可观察到发出白光且瓶壁上有 出现,证明蜡烛燃烧有水生成;接着,将蜡烛从集气瓶中取出, (填实验步骤和现象),证明蜡烛燃烧还生成了二氧化碳。
大雨过后,某课外兴趣小组的同学从河水中取样,进行净化处理实验。请回答下列问题:(1)同学们向河水样品中加入_____________________________________使悬浮物沉降,然后进行过滤,请指出如图所示操作中的错误_____________________________________;(答一点即可)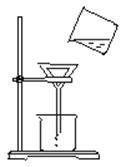
(2)该小组同学向得到的滤液中加入活性炭,利用它的————————除去水中的色素和异味的物质,此过程发生了—————————(填“物理变化”或“化学变化”);
(3)经过以上操作后,所得到的———————(填“一定”或“不一定”)是软水。