海水、河水或湖水中,都溶解了一定量的氧气,但养鱼池中或长途运输活鱼常常由于鱼多而缺氧,因此要设法增加水中的氧气含量。
材料一:已知过氧化钠(Na2O2)与水较快反应,反应方程式是2Na2O2+2H2O═4NaOH+O2↑
过氧化钙(CaO2)与Na2O2性质相似,与水缓慢反应放出氧气。
材料二:20℃时,NaOH的溶解度为109g,Ca(OH)2的溶解度为0.165g。
(1)试写出CaO2与H2O反应的化学方程式 ;
(2)长途运输活鱼,人们选择CaO2而不选择Na2O2作增氧剂的理由可能是 (写出一条即可)。
“化学为生命密码解锁”,“DNA”承载着生命遗传的密码,胞嘧啶(C4H5ON3)是DNA水解产物之一.
(1)胞嘧啶中碳、氢、氧、氮四种元素的质量比为;
(2)g胞嘧啶中含32g氧元素?
向阳中学化学兴趣小组在实验室用大理石和稀盐酸反应制取二氧化碳完毕后,他们对废液中溶质的成分产生了兴趣。请参与探究并回答下列问题:
【提出问题】废液中的溶质是什么物质?
【作出猜想】小刚同学认为废液中溶质只有氯化钙。
你认为还可能有的溶质是________________(填化学式)。
【查阅资料】氯化钙溶液呈中性,碳酸钙不溶于水。
【实验与结论】(1)小刚同学取少量废液于试管中,滴入几滴无色酚酞溶液后,酚酞不变色。于是小刚同学认为自己的猜想是正确的。
(2)你认为小刚同学的实验_____(填“能”或“不能”)证明他的猜想,理由是________。
(3)如果要证明你的猜想是正确的,实验过程如下:
| 实验操作 |
实验现象 |
实验结论 |
|
甲同学 |
取烧杯中溶液少许于试管中,向其中滴加_____ |
现象:溶液变为红色 |
溶液显酸性(含有H+);溶质中有氯化氢。 |
乙同学 |
取烧杯中溶液少许于试管中,向其中加入少量锌粒 |
现象:_________________________ 反应的化学方程式是: ____________________________ |
|
丙同学 |
取烧杯中溶液少许于试管中,向其中加入少量石灰石 |
现象:_________________________ ___________________________ |
【拓展与应用】(1)通过以上探究,如果该废液未经处理直接倒入下水道,可能造成的危害是___(写一条)。
(2)若要从剩余溶液中得到尽可能多的纯净的氯化钙固体,同学们认为可以向剩余溶液中加入稍过量的___________(填化学式),经__________、蒸发等操作后即可完成。
【交流与反思】在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑_______________。
如图所示A~F是初中化学常见的物质。图中“→”表示转化关系,“—”表示相互能反应。已知A是人体胃液中含有的酸,可帮助消化,D是最轻的气体,B和C含有相同的组成元素。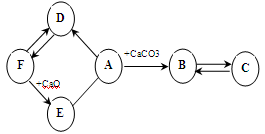
(1)写出F的化学式,
E物质的一种用途,
C物质的一条化学性质;
(2)A→B发生的反应的化学方程式;
(3)A和E发生的反应的化学方程式。
“低碳生活”是指生活作息时所耗用的能量要尽力减少,从而减低碳特别是CO2的排放量。已知硅能在O2中燃烧生成SiO2,并放出大量的热,有科学家正在研究将硅作为新能源。与化石燃料相比较,硅燃烧没有CO2排放,因而有助于解决的环境问题是。工业上制取粗硅的化学方程式为SiO2 +2C高温Si+2X↑,则X的化学式为,该化学反应的基本类型是。
A、B、C三个烧杯中盛有相同质量的水(其中A、C烧杯中水温为10℃,B烧杯中水温为30℃,不考虑溶解过程中温度的变化),分别加入甲、乙两物质各10g,充分溶解后所得现象如下图所示,试回答:
(1)你认为_______(填A、B、C)烧杯中的溶液可能是不饱和溶液。
(2)下图是甲、乙两种物质的溶解度曲线图,按图分析,10℃时,A、C两烧杯中未溶解的溶质质量关系是________(填“相等”或“不相等”)。其它条件不变,将C烧杯中的温度升到30℃时,C烧杯中的溶液是__________(填“饱和”或“不饱和”)溶液。
(3)若将A烧杯中的溶质全部溶解,可采用的方法有:____________________________。