化学兴趣小组对贝壳中碳酸钙的含量进行探究。
【提出问题】
如何选择药品和设计装置进行测定?
【查阅资料】
贝壳的主要成分是CaCO3,其它成分对实验影响忽略不计。
室温时,CaCO3不溶于水,CaSO4微溶于水。
【设计与实验】
实验一:选择药品
分别取等质量颗粒状和粉末状的贝壳样品与等体积、等浓度的稀盐酸在图1的三颈烧瓶中反应,采集数据。

(1)图1中反应的化学方程式是 。
(2)据图2分析,选择粉末状样品的依据是 。
(3)据图3分析,影响实验测定准确性的原因:一是水蒸气含量增加;二是 。
实验二:设计装置

小组设计了图4装置进行测定。
(4)打开活塞,稀硫酸进入试管,观察到的现象是 。反应结束后进行读数。读数前调节水准管与量气管液面相平的原因是 。
实验三:优化装置
在老师指导下,小组优化并设计了图5装置进行测定。
(5)试剂a是 。
(6)检查该装置气密性的方法是 。
(7)加入足量稀硫酸,一段时间后反应停止。再加入氯化铵溶液,发现又产生气泡。推测加入氯化铵溶液的作用是 。
【数据处理】
(8)实验三中,样品质量为mg,加入稀硫酸体积为V1mL,加入氯化铵溶液体积为V2mL,右侧针筒最后读数为V3mL,则反应生成CO2体积为 mL.该实验条件下,CO2密度为dg/mL,则该样品中碳酸钙质量分数表达式为 。
【反思与评价】(9)与实验二相比,实验三的优点是 (写一条)。
将锌粉加入到一定质量Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,可以得到溶液和固体。
(1)写出会导致溶液质量变小的有关反应的化学方程式。
(2)若所得溶液中只含有一种溶质,请分析所得固体的成分。
如图是某反应的微观示意图。

(1)写出图中单质的化学式 。
(2)写出该反应的化学方程式 。
化学实验是科学探究的重要手段。
(1)某化学小组用图1装置制取氧气。
①A中发生反应的化学方程式为 。
②用A装置制取氧气时,长颈漏斗下端浸没在液面以下的原因是什么?
③若用B装置收集氧气,请将B装置中导管补画完整。若氧气已收集满,可观察到什么实验现象?
(2)已知甲酸(HCOOH)具有挥发性,在热的浓硫酸中分解生成一氧化碳和水。用图2微型实验装置制取CO,然后用CO还原Fe3O4,并检验气体产物。

①氢氧化钠固体的作用是 。
②写出B中Fe3O4发生反应的化学方程式。
③C中观察到的实验现象是什么?
(3)将20 g 碳酸钙加入到盛有100 g稀盐酸的烧杯中,反应后烧杯中有固体剩余物,且固体剩余物和溶液的总质量为115.6 g(气体的溶解忽略不计)。试计算反应前稀盐酸中溶质的质量分数。
已知粗盐中含有泥沙、氯化钙和硫酸镁等杂质。为制得纯净的氯化钠固体,某化学兴趣小组进行了如下操作: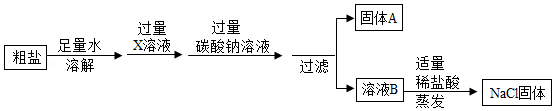
(1)写出X溶液中溶质的化学式 。
(2)请设计实验证明溶液B中含有NaOH.(简要写出实验步骤和现象)
(3)最后制得氯化钠的质量大于粗盐中氯化钠的质量,写出一个可使氯化钠质量增加的化学方程式 。
向硫酸中滴加氢氧化钠溶液并不断搅拌,如图为反应时溶液pH变化的示意图。
(1)请写出该反应的化学方程式。
(2)加入NaOH溶液a mL时,溶液中含有哪些溶质?
(3)若将b mL该氢氧化钠溶液滴入到与硫酸相同质量、相同质量分数的盐酸中,请判断反应后溶液的酸碱性。
